химическият елемент фосфор (P) принадлежи към третия период от Периодичната система и към семейството на азота (VA). Поради тази причина атомите му обикновено са три химически връзки за да достигне до теория на октета (стабилност). Има обаче някои ситуации, при които фосфорният атом създава повече от три връзки, факт, който е възможен само чрез феномен на хибридизация.
За да разберете фосфорна хибридизация, първо трябва да разберем защо атомът на този елемент прави три връзки. За да направим това, просто трябва да наблюдаваме електронното ви разпространение:

Електронно разпределение на фосфор
Можем да забележим, че във валентния слой фосфорният атом има пълното 3s подниво (с два електрона) и непълното 3р подниво (всяка от трите p орбитали на подниво има a електрон). По-долу имаме разпределението на електроните в орбиталите на поднивата на Фолен валентен слой:
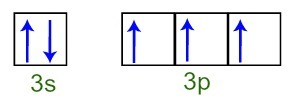
Представяне на електроните на валентната обвивка на фосфорния атом
Тъй като всяка от 3р орбиталите на подниво е непълна, фосфорният атом е в състояние да изгради три химически връзки, като по този начин постига стабилност.
Сега, когато разгледаме веществото PCl5например, ние сме сигурни, че в тази молекула фосфорът е подложен на хибридизация, тъй като е направил пет връзки. Тъй като хлорът, който принадлежи към семейство VIIA, се нуждае от връзка, за да бъде стабилен и молекулата има пет атома от това елемент, всеки от тях трябва да направи връзка, което прави фосфорния атом от своя страна също да направи пет Връзки. Това е възможно само чрез хибридизация (обединение на непълни атомни орбитали) на фосфор.
Когато получават енергия от външната среда, електроните на фосфорния атом се възбуждат. Скоро след това един от двата електрона, принадлежащи към 3-то подниво, се придвижва до празна орбитала, присъстваща в d-нивото, което дотогава няма никакви електрони. Вижте диаграмата по-долу:
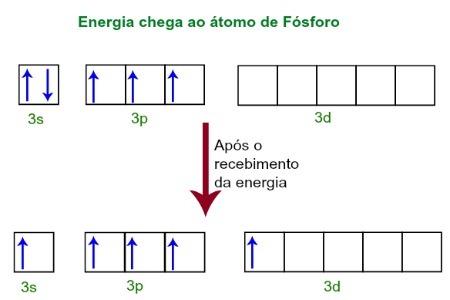
При получаване на енергия, електроните на фосфора се възбуждат и един заема орбитала от d поднивото.
В този момент във валентния слой на фосфора имаме орбитала s, три p орбитали и непълна d орбитала.В крайна сметка тези пет орбитали се хибридизират, т.е. сливат се, което води до пет непълни атомни орбитали, които сега са способни да образуват пет химически връзки.

Хибридизация на непълни атомни орбитали на фосфор
Като s орбитала, три р орбитали и d орбитала бяха съединени, фосфорната хибридизация е от типа sp3д.
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm


