Елементите от семейство 17 или VII A от Периодичната система се наричат халогени, представени от петте елемента, изброени по-долу: Флуор (F), хлор (Cl), бром (Br), йод (I) и астатин (At). Те често са представени в общи линии с буквата X.

Най-важните, поради ежедневното им приложение, са хлор, бром и йод.
Това име "халоген" означава "образуване на сол".
Всички те имат 7 електрона във валентната обвивка (електронна обвивка, най-отдалечена от ядрото и по-енергична). Общо: ns2 np5. В резултат на това те са склонни да получават електрон и да образуват отрицателни моновалентни йони (X-1), реагиращ главно с алкални метали (метали от фамилия 1), които са склонни да даряват електрон. По този начин те пораждат съединения с формули от типа MX.

Получавайки този електрон, халогените са стабилни, тъй като валентната им обвивка е пълна (с осем електрона) и характеристиките им се променят напълно. Например хлорен газ (Cl2) е зеленикаво-жълт, плътен, силно токсичен и реактивен газ, слабо разтворим във вода и реагира експлозивно с водород. Когато обаче
хлор (Cl) получава електрон от натрий (Na), те се превръщат в йони, образувайки натриев хлорид (NaCl) или готварска сол, която поглъщаме ежедневно и която е необходима за поддържането на живота ни. Хлорът особено става хлоридният йон (Cl-), което е необходимо в нашето тяло за образуването на солна киселина (HCl), основният компонент на стомашния ни сок.Всъщност хлорът е най-разпространеният халоген и се използва при производството на органични съединения, неорганични продукти, в производството на хартия (насочена към избелване на целулоза) и във вода и канализация. Също така е обичайно да се използва воден разтвор на натриев хипохлорит (NaClO), който се нарича „течен хлор“ и който е в състава на белина.
Интересен факт е, че въпреки че някои хора казват, че в плувните басейни се използва „твърд хлор“, всъщност това не е само елементът хлор, а калциевият хипохлорит (Ca (ClO)2).
Също така, подобен случай е използването на флуор - което всъщност не е флуор сам по себе си, а флуориди (йонни съединения, които съдържат елемента флуор) - при пречистване на питейна вода и в продукти за грижа за устната кухина.
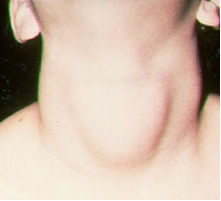
По отношение на йод, важно приложение е добавянето им (под формата на йодиди или натриеви и калиеви йодати), изисквано от закона, към трапезната сол. Това е така, защото липсата на йод в организма може да предизвика заболяване, наречено гуша, популярно известно като папо.
О бром това е червена течност, при стайна температура, плътна и нестабилна и тъй като е летлива, тя може да се изпари, образувайки червеникава пара. В природата не се среща изолирано, нито се използва в индустрията по този начин. Основните приложения на неговите съединения са: като катализатори за органични реакции, смесени с горива, във фотографски разработки, наред с други.
вече астатин това е радиоактивен елемент. Произходът му обикновено е резултат от радиоактивното разпадане на изотопите на уран и торий. Образува най-малко 20 изотопа, като At-210 е най-стабилен, с полуживот 8,3 часа. Това е много рядък елемент.
От Дженифър Фогаса
Завършва химия
