Капацитетът, който връзките трябва да привличат електрически заряди, се определя като полярност, която придобива различен характер в зависимост от връзката, където е налице.
Най-честите връзки, включващи органични съединения, се случват между въглеродни атоми или между въглеродни и водородни атоми: C ─ C и C ─ H (въглеводороди). Класифицираме този тип връзка като ковалентна, тя присъства във всички връзки на органични съединения, образувани само от въглерод и водород.
Когато в молекулата на органично съединение има друг химичен елемент освен въглерод и водород, неговите молекули ще имат определена полярност. Ние наричаме този елемент хетероатом и той може да бъде: азот (N), кислород (O), наред с други.
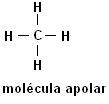
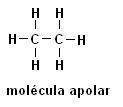
Метан (СН4) Етан (С2Н6)
Имайте предвид, че и в двете структури няма наличие на хетероатоми, в този случай молекулите са класифицирани като неполярни.


Наличието на кислород като хетероатом кара молекулите да показват полярност. Първата молекула е съединението етанол (CH3CH2о), присъствието на хидроксил - ОН придава на това съединение полярен характер, дори ако в неговата структура съдържа неполярна част.
От Лирия Алвес
Завършва химия
Училищен отбор на Бразилия
Виж повече! плосък изомер
Органична химия - Химия - Бразилско училище
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm


