Когато готвим храна в домовете си, използваме изгаряне на газ за готвене. Едно от нещата, които можем да видим в пламъка, произтичащ от изгарянето на този газ, е, че цветът му обикновено е много светлосин. Въпреки това, при повечето реакции на горене, като изгаряне на свещ, пламъкът е жълт.

Тогава възниква въпросът:
„Ако всеки пожар е резултат от реакция на горене, защо някои пламъци имат различни цветове?“
За да разберем как се случва това, трябва да разберем какво представлява реакцията на горене и какви вещества присъстват във всяка от споменатите реакции.
Реакция на горене възниква, когато гориво (окисляем материал) се изразходва от окислител (газообразен материал, съдържащ кислород) за генериране на топлинна енергия (топлина).
Друг важен момент, който трябва да знаем за реакциите на горене, е, че те могат да протичат в пълно или непълно. Ако има достатъчно кислород за изразходване на горивото, реакцията ще завърши и ще се получи въглероден диоксид (CO2) и вода (H2О). В противен случай изгарянето ще бъде частично, непълно, генерирайки въглероден окис (CO) и вода; или въглерод (С) и вода.
И в двата случая, които анализираме, окислителят е кислородът, присъстващ във въздуха. Горивата обаче са различни. Готварският газ всъщност е втечнен нефтен газ (LPG), който е смес от въглеводороди (алкани), като основното гориво е бутан (C4Н10). По този начин газът за готвене се състои от алканови молекули, които имат само три или четири въглеродни атома, затова е необходимо малко кислород, за да може изгарянето му да се осъществи напълно. Тази реакция може да бъде изразена по следния начин:
1С4Н10 (g) + 13/2 O2 (g) → 4 CO2 (g) + 5 часа2О(ж), ∆H <0
При свещите парафинът е горивото за реакцията и се състои от смес от алкани с въглеродни атоми, която варират от 20 до 36. По този начин, необходимо е много повече кислород, за да протече тази реакция напълно. Вижте пример:
1С24Н50 (и) + 70/2 O2 (g) → 25 CO2 (g) + 25 Н2О(ж), ∆H <0
Във въздуха няма достатъчно кислород, за да се извърши това пълно изгаряне, така че то се извършва непълно, както е показано по-долу:
1С24Н50 (и) +49/2 O2 (g) → 24 CO(ж) + 25 Н2О(ж), ∆H <0
1С24Н50 (и) +25/2 O2 (g) → 24C(с) + 25 Н2О(ж), ∆H <0
Непълните реакции произвеждат по-малко енергия от пълното изгаряне. Това обяснява разликата между цветовете на пламъците, тъй като жълтият пламък, характерен за непълно изгаряне, има по-ниска енергия. Синият пламък е характерен за пълно изгаряне, с по-голяма енергия.
Това също обяснява образуването на сажди от пламъка на свещта (на снимката по-долу), който е въглерод, считан за продукт на непълно изгаряне.
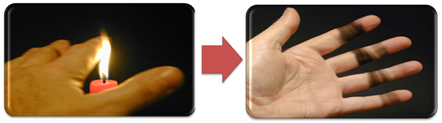
Но защо в горелката на Бунзен е възможно да се получат жълти и сини пламъци, когато горивото не се променя?
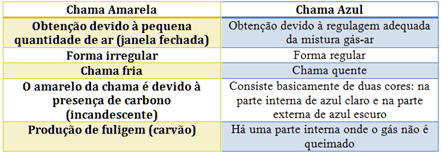
В случая с горелката Bunsen това се постига чрез регулиране на входа на газ и въздух. Ако прозорецът е затворен, което води до навлизане на малко количество въздух, полученият пламък ще бъде жълт, тъй като ще има малко кислород, за да извърши пълно изгаряне. Ако регулирането на сместа газ-въздух е адекватно, получаваме син пламък.
Вижте характеристиките на всеки в таблицата по-долу:
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm
