THE енталпия е термодинамична функция, чрез която изчислява топлината, участваща в изобарните процеси, тоест които се държат под постоянен натиск. Неговото развитие става малко след падането на калоричната теория, с напредването на термодинамика между 1840 и 1850 г.
Енталпията за Каквоumica, няма много значение, ако се работи като абсолютна и изолирана стойност, но има при разглеждане на промяна на стойността му в химичен процес. Има няколко начина за изчисляване на изменението на енталпията на даден процес, като основните са чрез енергиите на образуване, свързване, а също и чрез тамхей от хес.
Прочетете също: Какво представлява свободната енергия на Гибс?
Резюме на енталпията
Енталпията е термодинамичен инструмент за изчисляване на топлината, участваща в процеси, протичащи при постоянно налягане.
Той е определен от американския физик Джозая У. Гибс, в контекста на падането на калоричната теория.
В химията винаги използваме промяната на енталпията, представена като ΔH.
Химичните реакции, които поглъщат топлината, се наричат ендотермични и имат ΔH > 0.
Химичните реакции, които отделят топлина, се наричат екзотермични и имат ΔH < 0.
Видео урок по енталпия
Какво е енталпия?
Енталпията, винаги представена с H, първоначално беше определен от американския физик Джозая Уилард Гибс, която той нарече функция на топлина при постоянно налягане, тъй като по неговите думи:
„[…] намаляването на функцията представлява, във всички случаи, когато налягането не варира, топлината, отделена от системата.“
От работата на Гибс тогава можем да разберем енталпията като термодинамична функция, чиято вариацията е числено равна на количеството топлина, обменена в системата, до налягане постоянен. Това означава, че в изобарните процеси (както повечето химични процеси), знанието изчислете вариацията на функцията на енталпията, след това може да се знае стойността на топлообмена между системата и квартал.

Такава корелация с топлината причинява много ученици погрешно смятат, че енталпията е синоним на топлина или нещо като енергийно съдържание, топлинно съдържание, отделена топлина и абсорбирана топлина и други подобни.
Енталпията възниква в контекста на срива на калоричната теория, която третира топлината като невъзможна материална субстанция, която се прехвърля от по-топли тела към по-студени тела. По този начин имаше нужда от нов инструмент за изчисляване на топлината. Тогава решението беше да се използват количества, които вече имат дефинирани термодинамични уравнения, като енталпия.
Прочетете също: Как да изчислим промяната на енталпията на разтвора?
вариация на енталпията
Тъй като енталпията е инструмент, използван за изчисляване на топлината, обменена в химичен процес, няма смисъл да се използва като абсолютно, изолирано число, но като се има предвид неговата вариация, тоест на практика, трябва само да преценим колко числено се е променила енталпията по време на химическия процес, тъй като термодинамиката ни уверява, че нейната вариация е числено равно на топлината, отделена или погълната в процеса.
Строго погледнато, можем да дефинираме вариацията на енталпията като:
ΔH = HФинал - Хначален
Както при химичните процеси, последната стъпка може да се счита за продуктите, а началната стъпка може да се счита за реагентите. Също така е обичайно да се види дефиницията за вариация на енталпията като:
ΔH = Hпродукти - Хреагенти
От практическа и интерпретативна гледна точка, ако промяната на енталпията е положителна (ΔH> 0), ние казваме, че химическата реакция е ендотермичен, тоест има абсорбция на топлина през целия процес. Вече ако промяната на енталпията е отрицателна (ΔH< 0), ние казваме, че химическата реакция е екзотермичен, тоест топлината се отделя по време на процеса.
Вариацията на енталпията в много случаи се наблюдава в графики, както е показано в следващите примери.
Пример 1:
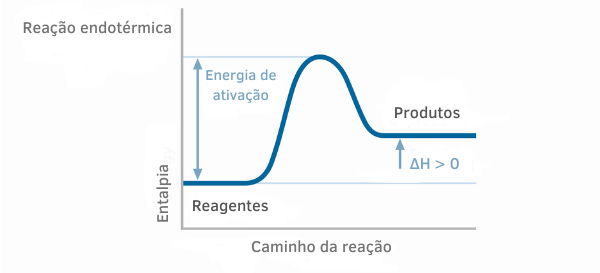
Диаграма на ендотермичните реакции
В графиките на енталпията за ендотермични реакции може да се види, че количеството на енталпията на продуктите е по-голямо от това на реагентите, което показва, че вариацията по протежение на реакцията е положителна. По този начин, ако ΔH > 0, можем да кажем, че химическият процес е протекъл с абсорбция на топлина.
Пример 2:
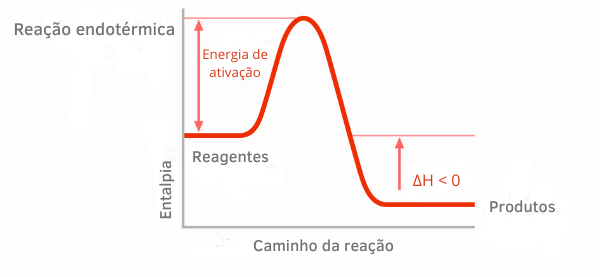
Таблица на екзотермичните реакции:
В графиките на енталпията за екзотермични реакции може да се види, че количеството на енталпията на продуктите е по-малко от това на реагентите, което показва, че вариацията по протежение на реакцията е отрицателна. По този начин, тъй като ΔH < 0, можем да кажем, че химическият процес е настъпил с отделянето на топлина.
Прочетете повече за тези класификации на химичните реакции в текста: ЗАендотермични и екзотермични процеси.
Видове енталпия
енталпия на образуване
THE енталпия на образуване é изчислено базирани на образуване на химични реакции, които са реакции, при които един мол съставни вещества се образува от техните най-стабилни прости вещества при стайна температура и 1 атмосфера налягане.
Х2(ж) + ½ O2 (ж) → H2O (l) H°е = -286 kJ/mol
Голямото предимство на енталпията на образуване е, че простите вещества, които са по-стабилни при стайна температура и 1 атмосфера налягане, имат енталпия, съгласувана с нула. Това не означава, че те всъщност са нула, но за опростяване и по-добра класификация се третират по този начин.
Битие Х = Hпродукти - Хреагенти, ако вземем предвид, че Хреагенти = 0, можем да кажем, че наблюдаваната стойност на ΔH е свързана само с продуктите, които в тези случаи винаги са един мол от съединението. Следователно, ние представяме тази стойност като стандартна промяна на енталпията на образуването на вода, представена с ΔH°е.
Именно с тази методология няколко вещества имаха своите вариации стандартна енталпия формационни таблици, както можем да видим по-долу.
Вещество |
Енталпия на образуване (ΔH°е) в kJ/mol |
CO2 (ж) |
-393,4 |
CaO(s) |
-634,9 |
HI(g) |
+25,9 |
НЕ (g) |
+90,1 |
енталпия на свързване
Енталпията на свързване служи за показване на количеството енергия, участващо в разкъсването или образуването на дадена мола. химическа връзка.
Разбираемо е, че за да се разруши химическа връзка, е необходимо да се абсорбира топлина, така че свързващите атоми увеличават своите вътрешна енергия и следователно да увеличите кинетичната си енергия. с по-голям кинетична енергия, атомите вибрират по-интензивно, което води до разкъсване на връзките. Следователно всяко прекъсване на връзката е ендотермичен процес.
В противен случай, за да образуват химическа връзка, атомите губят свобода на движение и трябва да намалят степента си на движение, намалявайки кинетичната си енергия. След това резервната енергия се освобождава под формата на топлина. Поради това, цялото образуване на връзки е екзотермичен процес.
Таблицата по-долу показва стойностите на енергиите, свързани с всяка химическа връзка.
Връзка |
Енергия на свързване (kJ/mol) |
C-H |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
НЕ |
943,8 |
Имайте предвид, че в стойностите няма знаци, тъй като те са по модул. Това е така, защото сигналът трябва да бъде зададен от вас в зависимост от това дали връзката е прекъсната или образувана.
Енталпия на горене
THE енталпия на горене служи за обозначаване на количество топлина, отделена при изгарянето на един мол вещество. Трябва да се отбележи, че всяка реакция на горене е екзотермична, тъй като всяко изгаряне отделя топлина.
CH4 (ж) + 2 О2 (ж) → CO2 (g) + 2 Н2ΔH°° С = -889,5 kJ/mol
Таблицата по-долу показва стойностите на енталпията на горене за някои химични вещества.
Вещество |
Енталпия на горене (ΔH°° С) в kJ/mol |
Етанол - C2Х5ОН (1) |
-1368 |
Бензол - C6Х6 (1) |
-3268 |
Октан - C8Х18 (1) |
-5471 |
Глюкоза - C6Х12О6 (с) |
-2808 |
Енталпия на промяната на физическото състояние
Всяка промяна във физическото състояние включва топлообмен. Следователно, на енталпия на промяната на физическото състояние служи за обозначаване на количество топлина, участващо в процесите на промяна на физическото състояние.
Например, имаме водно изпаряване:
Х2O (1) → H2O (g) ΔH = +44 kJ/mol
При топенето на водата имаме:
Х2O(s) → H2O (l) ΔH = +7,3 kJ/mol
Стойностите на енталпията са симетрични за обратните процеси, което означава, че например промяната на енталпията при втечняването на водата е -44 kJ/mol, докато при нейното втвърдяване тя е равна на -7,3 kJ/mol.
Прочетете също: Какво е ентропия?
Решени упражнения върху енталпия
Въпрос 1 - (UERJ 2018) Капацитетът на замърсяване на въглеводород, използван като гориво, се определя от съотношението между освободената енергия и количеството CO2 образува се при пълното му изгаряне. Колкото по-високо е съотношението, толкова по-нисък е замърсяващият капацитет. Таблицата по-долу показва стандартната енталпия на изгаряне на четири въглеводорода.

От таблицата въглеводородът с най-нисък замърсяващ капацитет е:
Октан
хексан
Бензол
пентан
Резолюция
Алтернатива D
Въпросът показва, че замърсяващият капацитет се определя като съотношението (коефициент) между освободената енергия и количеството CO2 образува се при пълното му изгаряне. Колкото по-голям е причина, толкова по-нисък е замърсяващият капацитет, тоест повече енергия се отделя на мол CO2 генерирани.
Пълните реакции на горене на Въглеводороди цитирани са:
Октан: ° С8Х18 +25/2 О2 → 8 CO2 + 9 часа2Причината: 5440/8 = 680
хексан: ° С6Х14 +19/2 О2 → 6 CO2 + 7 часа2Причината: 4140/6 = 690
Бензол: ° С6Х6 + 15/2 О2 → 6 CO2 + 3 Н2Причината: 3270/6 = 545
пентан: ° С5Х12 + 8 О2 → 5 CO2 + 6 Н2Причината: 3510/5 = 702
По този начин можем да заключим, че пентанът е въглеводородът с най-нисък замърсяващ капацитет.
Въпрос 2 - (Enem 2015) Използването на горски остатъци става все по-привлекателно всеки ден, тъй като те са възобновяем източник на енергия. Фигурата представя изгарянето на биомасло, извлечено от дървесни отпадъци, където ΔH1 изменението на енталпията поради изгарянето на 1 g от това биомасло, което води до въглероден диоксид и течна вода, и ΔH2 промяната на енталпията, участваща в превръщането на 1 g вода в газообразно състояние в течно състояние.

Вариацията на енталпията, в kJ, за изгаряне на 5 g от това биомасло, което води до CO2 (газообразен) и H2(газообразният) е:
А) -106
Б) -94
В) -82
Г) -21,2
Д) -16,4
Резолюция
Алтернатива C
От показаната графика имаме ΔH1 като изменение на енталпията при изгаряне на биомасло, произвеждащо CO2 (ж) и Н2O (1) и ΔH2 като промяна на енталпията на втечняването на водата, тъй като CO2 остава газообразен и само физическото състояние на Вода промени (от газ към течност).
Упражнението изисква промяна на енталпията при изгаряне на 5 g биомасло, което води до CO2 (газообразен) и H2O (газообразен). От диаграмата тази промяна на енталпията може да се дефинира като ΔH = ΔH1 – Х2. По този начин стойността на ΔH ще бъде равна на -16,4 kJ/g. Тази вариация, както виждаме в единицата, е за ВСЕКИ грам биомасло. За 5 грама трябва да направим пропорция:
1 g биомасло -16,4 kJ
5 г био-масло х
1. х = 5. (-16,4)
x = -82 kJ
След това можем да маркираме алтернатива C.
От Стефано Араужо Новаис
Учител по химия