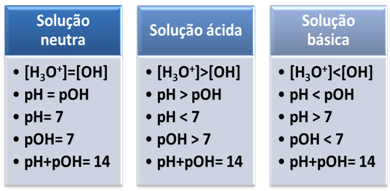
Една среда се счита за неутрална, ако има същата концентрация, в mol/L, на хидрониеви йони (H3О+) и хидроксид (ОН-).
Пример за неутрална среда, която дори служи като стандарт за други разтвори, е чиста дестилирана вода при температура 25ºC. При тази температура има точно 1. 10-7 mol/L от двата йона. Следователно вашият йонен продукт (Kw) е равно на 10-14 (mol/L)2:
Кw = [H3О+]. [о-]
Кw = (1. 10-7 mol/L). (1. 10-7 mol/L) = 10-14 (mol/L)2
pH и pOH са дадени по-долу:
pH= - log [H3О+] pOH= -log[OH-]
pH= - log 1. 10-7 pOH= - log 1. 10-7
рН = 7рОН = 7
Това ни показва, че в неутрално решение, pH е равно на pOH.
- киселинна среда:
В кисела среда концентрацията на Н йони3О+ е по-голям от този на ОН йони-.
Такова решение може да се постигне чрез добавяне на малка част от Н йони3О+, например, с помощта на киселина.
Според принципа на Льо Шателие, когато е причинено смущение в система в равновесие, тя има тенденция да се пренастрои, за да намали ефекта на тази сила. Това означава, че ако към водата се добави киселина, йоните на Н
3О+ те ще бъдат в излишък и балансът ще се измести в посока на обратната реакция, наляво. Така че тези излишни йони ще реагират с ОН йони-. По този начин концентрацията на ОН йони- ще намалее и разтворът ще стане кисел.
Йонният продукт (Kw) винаги е равен на 10-14, но концентрацията на Н йони3О+ е по-голяма от концентрацията на ОН йони-1. Следователно рН е по-голямо от рОН в кисела среда, но неговата сума винаги е равна на 14.
Също така, толкова по-голяма е концентрацията на Н йони3О+, толкова по-висока е стойността на pH. При стайна температура (25°C), pH < 7 и pOH > 7.

- Основни средства:
В основната среда концентрацията на ОН йони- е по-голям от този на Н йони3О+.
Ако добавим основа към водата, това означава, че добавяме ОН йони.- и, както беше обяснено в предходната точка, от принципа на Льо Шателие, равновесието на реакцията на самойонизацията на водата ще се движи в обратна посока, като излишните йони реагират с Н йони3О+, намалявайки концентрацията си и превръщайки разтвора в основен.
В този случай рОН ще бъде по-голямо от рН. При стайна температура (25°C), pH > 7 и pOH < 7.

накратко:
От Дженифър Фогаса
Завършил химия
