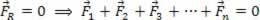Термодинамиката е област на физиката, която изучава енергийните трансфери. Той се стреми да разбере връзките между топлината, енергията и работата, като анализира количествата топлообмен и работата, извършена във физически процес.
Термодинамичната наука първоначално е разработена от изследователи, които търсят начин да подобрят машините, в периода на индустриалната революция, подобрявайки тяхната ефективност.
Понастоящем тези знания се прилагат в различни ситуации от нашето ежедневие. Например: термични машини и хладилници, автомобилни двигатели и процеси за трансформация на минерали и петролни продукти.
Закони на термодинамиката
Основните закони на термодинамиката управляват начина, по който топлината става работа и обратно.
Първи закон на термодинамиката
НА Първи закон на термодинамиката се отнася до принцип на енергоспестяване. Това означава, че енергията в системата не може да бъде унищожена или създадена, а само трансформирана.
Формулата, която представя първия закон на термодинамиката, е както следва:

Количеството топлина, работата и варирането на вътрешната енергия имат за стандартна мерна единица Джоул (J).
Практически пример за пестене на енергия е, когато човек използва помпа за надуване на надуваем обект, той използва сила, за да изпомпва въздух в обекта. Това означава, че кинетичната енергия кара буталото да слиза надолу. Част от тази енергия обаче се трансформира в топлина, която се губи за околната среда.
НА Закон на Хес е частен случай на принципа на енергоспестяване. Знам повече!
Втори закон на термодинамиката
В топлообмен те винаги се случват от най-топлото тяло до най-студеното тяло, това се случва спонтанно, но не и обратното. Което ще рече, че процесите на трансфер на топлинна енергия са необратими.
По този начин от Втори закон на термодинамиката, не е възможно топлината да се преобразува напълно в друга форма на енергия. Поради тази причина топлината се счита за влошена форма на енергия.

Физическата величина, свързана с Втория закон на термодинамиката, е ентропия, което съответства на степента на разстройство на дадена система.
Прочетете също:
- Цикъл на Карно
- Термично разширение
Нулев закон на термодинамиката
НА Нулев закон на термодинамиката се занимава с условията за получаване на термичен баланс. Сред тези условия можем да споменем влиянието на материали, които правят топлопроводимостта по-висока или по-ниска.
Според този закон,
- ако тяло А е в топлинно равновесие в контакт с тяло В и
- ако това тяло А е в топлинно равновесие в контакт с тяло С, тогава
- B е в термично равновесие в контакт с C.
Когато две тела с различни температури са в контакт, това, което е по-топло, ще предава топлина към това, което е по-хладно. Това води до изравняване на температурите при достигане на термичен баланс.
Нарича се нулев закон, защото разбирането му се оказа необходимо за първите два закона, които вече съществуват, първия и втория закон на термодинамиката.
Трети закон на термодинамиката
НА Трети закон на термодинамиката изглежда като опит за установяване на абсолютна референтна точка, която определя ентропията. Ентропията всъщност е основата на Втория закон на термодинамиката.
Валтер Нернст, физикът, който го предложи, заключи, че не е възможно чисто вещество с температура нула да има ентропия при приблизителна стойност нула.
Поради тази причина това е противоречив закон, считан от много физици като правило, а не като закон.
термодинамични системи
В термодинамичната система може да има едно или няколко тела, които са свързани. Околната среда, която го заобикаля, и Вселената представляват външната за системата среда. Системата може да бъде определена като: отворена, затворена или изолирана.
 термодинамични системи
термодинамични системи
Когато системата се отвори, има трансфер на маса и енергия между системата и външната среда. В затворената система има само пренос на енергия (топлина), а когато е изолиран, няма обмен.
поведение на газовете
Микроскопичното поведение на газовете е по-лесно описано и интерпретирано, отколкото при други физични състояния (течно и твърдо). Ето защо газовете се използват най-много в тези изследвания.
При термодинамичните изследвания се използват идеални или перфектни газове. Това е модел, при който частиците се движат хаотично и си взаимодействат само при сблъсъци. Освен това се счита, че тези сблъсъци между частиците и между тях и стените на контейнера са еластични и продължават много кратко.
В затворена система идеалният газ предполага поведение, което включва следните физически величини: налягане, обем и температура. Тези променливи определят термодинамичното състояние на даден газ.
 Поведение на газовете съгласно газовите закони
Поведение на газовете съгласно газовите закони
Налягане (p) се получава от движението на газови частици вътре в контейнера. Пространството, заето от газа в контейнера, е обемът (v). А температурата (t) е свързана със средната кинетична енергия на движещите се частици газ.
Прочетете и вие Закон за газа и Изследване на газовете.
вътрешна енергия
Вътрешната енергия на системата е физическа величина, която помага да се измери как се случват трансформациите, на които се подлага един газ. Тази величина е свързана с промяната в температурата и кинетичната енергия на частиците.
Идеалният газ, съставен само от един вид атом, има вътрешна енергия, пряко пропорционална на температурата на газа. Това е представено със следната формула:

Решени упражнения по термодинамика
Въпрос 1
Цилиндърът с подвижно бутало съдържа газ при налягане 4.0.104N / m2. Когато към системата се подава 6 kJ топлина, при постоянно налягане, обемът на газа се разширява с 1.0.10-1м3. Определете свършената работа и промяната във вътрешната енергия в тази ситуация.
Точен отговор: извършената работа е 4000 J, а вътрешната енергийна промяна е 2000 J.
Данни:
P = 4,0.104 N / m2
Въпрос: = 6KJ или 6000J
ΔV = 1,0.10-1 м3
T =? ΔU =?
1-ва стъпка: Изчислете работата с данните за проблема.
T = P. ΔV
Т = 4.0.104. 1,0.10-1
T = 4000 J
2-ра стъпка: Изчислете вариацията на вътрешната енергия с новите данни.
Q = T + ΔU
ΔU = Q - T
ΔU = 6000 - 4000
ΔU = 2000J
Следователно извършената работа е 4000 J, а вътрешната промяна на енергията е 2000 J.
въпрос 2
(Адаптиран от ENEM 2011) Двигателят може да работи само ако получава количество енергия от друга система. В този случай енергията, съхранявана в горивото, отчасти се освобождава по време на горенето, за да може уредът да функционира. Когато двигателят работи, част от енергията, преобразувана или трансформирана при горенето, не може да се използва за работа. Това означава, че има изтичане на енергия под друга форма.
Според текста енергийните трансформации, които се случват по време на работа на двигателя, се дължат на:
а) отделянето на топлина вътре в двигателя е невъзможно.
б) работата, извършена от двигателя, е неконтролируема.
в) пълното преобразуване на топлината в работа е невъзможно.
г) превръщането на топлинната енергия в кинетика е невъзможно.
д) потенциалната енергийна употреба на горивото е неконтролируема.
Правилна алтернатива: в) пълното преобразуване на топлината в работа е невъзможно.
Както се вижда по-рано, топлината не може да се превърне напълно в работа. По време на работата на двигателя част от топлинната енергия се губи, пренасяйки се във външната среда.
Вижте също: Упражнения по термодинамика