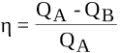Първият закон на термодинамиката се занимава с това, което е необходимо, за да се превърне работата в топлина.
Тя се основава на принцип на енергоспестяване, което е един от най-важните принципи на физиката.
Това запазване на енергията се осъществява под формата на топлина и работа. Това дава възможност на системата да съхранява и прехвърля енергия, тоест енергията може да се увеличава, намалява или остава постоянна.
Първият закон на термодинамиката се изразява с формулата
Q = τ + ΔU
Където,
Въпрос:: топлина
τ: работа
U: вариация на вътрешната енергия
По този начин неговата основа е: топлината (Q) е резултат от сумата на работата (τ) с вариацията на вътрешната енергия (ΔU).
Може да се намери както следва:
ΔU = Q - W
Където,
U: вариация на вътрешната енергия
Въпрос:: топлина
W: работа
Фондацията води до същото: варирането на вътрешната енергия (ΔU) е резултат от топлообмена с външната среда минус извършената работа (W).
Това означава,
1) като за топлина (Q):
- Ако топлообменната среда със средата е по-голяма от 0, системата получава топлина.
- Ако топлообменната среда със средата е по-малка от 0, системата губи топлина.
- Ако няма обмен на топлина със средата, т.е. ако е равен на 0, системата нито получава, нито губи топлина.
2) по отношение на работата (τ):
- Ако работата е по-голяма от 0, обемът на нещо, изложено на топлина, се разширява.
- Ако работата е по-малка от 0, обемът на нещо, изложено на топлина, се намалява.
- Ако няма работа, тоест, ако е равна на 0, обемът на нещо, изложено на топлина, е постоянен.
3) по отношение на вариацията на вътрешната енергия (ΔU):
- Ако варирането на вътрешната енергия е по-голямо от 0, има повишаване на температурата.
- Ако варирането на вътрешната енергия е по-малко от 0, има понижение на температурата.
- Ако няма промяна във вътрешната енергия, т.е. ако е равна на 0, температурата е постоянна.
Прави се заключението, че температурата може да се повиши с топлина или с работа.
Пример
Нагряването на газове кара машините да стартират, т.е. да извършват работа в инсталация например.
Това се случва по следния начин: газовете пренасят енергия вътре в машините, което ги кара да увеличават обема си и оттам активират механизмите на машините. Когато се активират, механизмите започват да работят.
Прочетете и вие
- Термодинамика
- Цикъл на Карно
- Закон на Хес
Закони на термодинамиката
Законите на термодинамиката са четири. В допълнение към първата, с която се занимаваме, има:
- Нулев закон на термодинамиката - занимава се с условията за постигане на топлинно равновесие;
- Втори закон на термодинамиката - занимава се с пренос на топлинна енергия;
- Трети закон на термодинамиката - занимава се с поведението на материята с ентропия, близка до нулата.
Упражнения
1. (Ufla-MG) При обратима газообразна трансформация варирането на вътрешната енергия е + 300 J. Имаше компресия и работата, извършена от налягането на газа, в модул е 200 J. Така че е вярно, че газта
а) даде 500 J топлина на средата
б) даде 100 J топлина на средата
в) получи 500 J топлина от средата
г) получи 100 J топлина от средата
д) претърпя адиабатна трансформация
Алтернатива d: получи 100 J топлина от средата
Вижте също: Упражнения по термодинамика
2. (MACKENZIE-SP) Като държите тесен отвор в устата си, издухайте енергично ръката си сега! Видя ли? Получихте адиабатна трансформация! В него въздухът, който изгонихте, претърпя силно разширение, по време на което:
а) извършената работа съответства на намаляването на вътрешната енергия на този въздух, тъй като не е имало топлообмен с външната среда;
б) извършената работа съответства на увеличаването на вътрешната енергия на този въздух, тъй като не е имало топлообмен с външната среда;
в) извършената работа съответства на нарастването на количеството топлина, обменяно от този въздух със средата, тъй като не е имало промени във вътрешната му енергия;
г) не е извършена работа, тъй като въздухът не абсорбира топлина от околната среда и не претърпява никакви промени във вътрешната енергия;
д) не е извършена работа, тъй като въздухът не отделя топлина на средата и не претърпява никаква промяна във вътрешната енергия.
Алтернатива а: извършената работа съответства на намаляването на вътрешната енергия на този въздух, тъй като няма топлообмен с външната среда.
Вижте също: адиабатна трансформация