Може да се случи, че има киселини от един и същ елемент и този елемент има същото окислително число (NOX), но разликата е в степента на хидратация.
Например по-долу имаме три киселини, образувани от елемента фосфор (P):
Н3ПРАХ4 Н4P2О7 HPO3
Имайте предвид, че и при трите киселини окислителното число на фосфора е +5; разликата е в степента на хидратация.
Въз основа на това тези киселини се диференцират в номенклатурата чрез префиксите орто, пиро и мета.
Най-хидратираната киселина се нарича орто. В дадения пример първият (H3ПРАХ4) е наречен киселина ортофосфорна, защото е най-хидратиран от трите. Орто префиксът е изразходваем, така че през повечето време тази киселина просто ще бъде извикана фосфорна киселина.
Префиксите pyro и meta се използват с орто киселина като отправна точка:
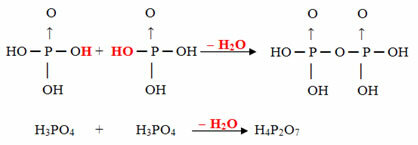
- Пирус: 2 молекули орто минус 1 молекула Н2О
Пример: H4P2О7 е наречен киселина пирофосфорна защото е равна на две молекули ортофосфорна киселина (Н3ПРАХ4) минус една водна молекула.
2. Н3ПРАХ4 = Н6P2О8
Н6P2О8 - З.2O = H4P2О7
Този процес е междумолекулна дехидратация:
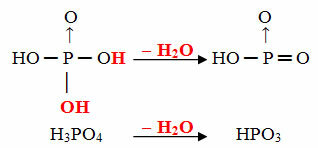
- Цел: 1 молекула орто минус 1 молекула Н2О
Пример: HPO3 е наречен киселина целфосфорна тъй като е равна на молекула ортофосфорна киселина (Н3ПРАХ4) минус една водна молекула.
Н3ПРАХ4 - З.2O = HPO3
Този процес е вътремолекулна дехидратация:
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm