Хибридизация на sp-тип въглерод2 възниква, когато има двойна връзка и две единични връзки или pi връзка (π) и три сигма връзки (σ). Всъщност, sp хибридизация2 възниква между атомите, които установяват двойната връзка.
Пример за такава молекула е формалдехидът (СН2О). Обърнете внимание на структурата му по-долу:
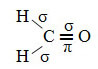
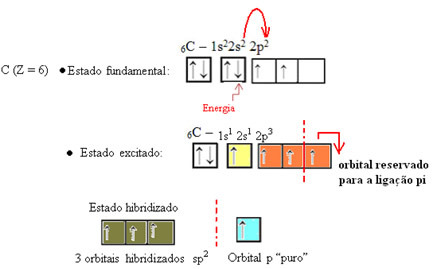
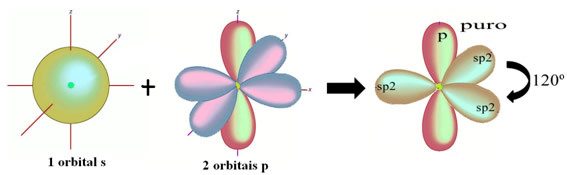
Както се вижда в текста "sp тип хибридизация3”, Въглеродната хибридизация се случва, когато електрон от подниво 2s получава енергия и се„ транспортира ”до 2p подниво и по този начин произхождат 4 хибридизирани орбитали от „комбинацията“ от атомни орбитали чист.
В случая на формалдехид знаем, че ще има pi връзка, така че една от тези хибридизирани орбитали е запазена за тази връзка, докато останалите три изпълняват сигма връзките:
Водородните атоми, които образуват единичната връзка с въглерод, го правят със своята орбитала:
Останалата "чиста" р-орбитална двойна връзка кислородния атом и молекулата на формалдехида има следната структура:
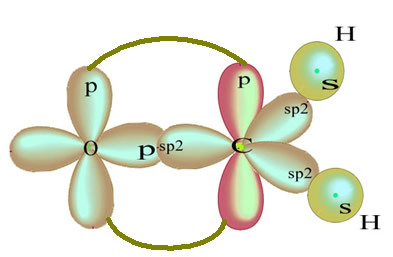
Що се отнася до вида връзки, съществуващи в тази формалдехидна структура, имаме:

Връзки: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πп-п
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm
