Обемен анализ или обем това е лабораторна процедура, при която използваме определен обем от a решение в концентрация известно, че определя концентрацията на друг разтвор. Обемът на разтвора с известна концентрация ще бъде определен, когато той напълно реагира с разтвора с неизвестна концентрация, т.е. участващите разтвори трябва да реагират помежду си.
Инструментите, най-използвани за измерване на даден обем, са:
- Пипета

Пример за пипета, използвана при измерване на обема
- Бюрета

Бюретата е важно обемно измервателно оборудване
Измерването на обема се извършва чрез оценка на височината на така наречения менискус, което не е нищо повече от повърхностната област на течността, която представлява правоъгълен или куполообразен аспект (форма на капка), в зависимост от дебелината на контейнера. Колкото по-широк е контейнерът, толкова по-правоъгълен е менискусът; колкото по-тънък е контейнерът, толкова по-изпъкнал ще бъде. За да оценим менискуса, окото трябва да е точно на височината си и трябва да използваме долната област като еталон, ако менискусът е правоъгълен, или върха, ако е изпъкнал Вижте представяне на оценка:
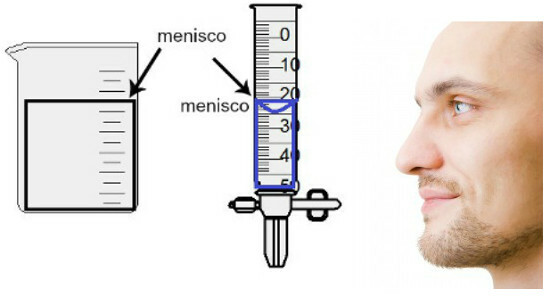
За да оцените менискус, важно е очите ви да гледат към него.
При обемния анализ най-използваното оборудване е бюретата. Това е така, защото, тъй като методът включва химични реакции и те могат да бъдат обработени бързо, бюретата позволява течността се отделя на върха си на капки, което ни позволява да спрем течността да излиза повече контролиран.
Една от най-използваните процедури в рамките на обем е титруване. Това е обемен анализ, който включва възникването на реакция между киселина и основа или обратно. Оборудването, необходимо за реализацията му, е представено на изображението по-долу:
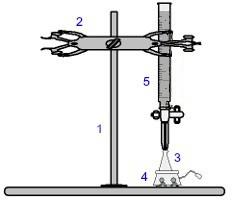
Представяне на оборудването, използвано при титруване
Цифрите в синьо означават:
1) Универсална поддръжка;
2) Нокът (използва се за задържане на бюретата);
3) Ерленмайер (получава разтвора с неизвестна концентрация);
4) Магнитна бъркалка (използва се за разбъркване на разтвора, присъстващ в колбата на Ерленмайер);
5) Бюрета (получава разтвора с известна концентрация).
Към ерленмайеровата колба се добавя обем от разтвор с неизвестна концентрация с фенолфталеинов индикатор (веднага разтворът ще стане розов). В бюретата се поставя определен обем от разтвора с известна концентрация. След това киселинният разтвор от бюретата директно се капе в основния разтвор в колбата на Ерленмайер. Това капене продължава, докато основният разтвор стане безцветен, в този момент ние наричаме точка на превръщане, което показва, че цялата основа, присъстваща в разтвора, е напълно реагирала с киселината.
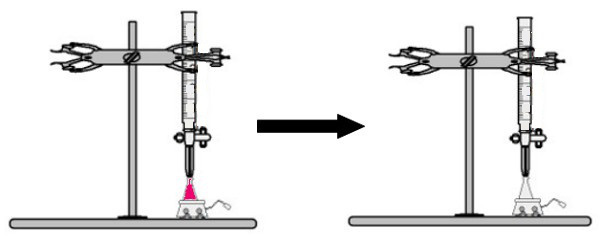
В преломната точка разтворът вече не е розов и става безцветен
Наблюдение: Ако разтворът с неизвестна концентрация е киселина, когато получи индикатора за фенолфталеин, той ще бъде безцветен. По този начин, повратната точка при титруването ще бъде, когато киселинният разтвор стане розов при получаване на основния разтвор от бюретата.
И накрая, за да определите концентрацията на основния разтвор, просто използвайте следното уравнение:
Ma.Va = Mb.Vb
Ma = киселинна моларност;
Va = киселинен обем;
Mb = базова моларност;
Vb = базов обем.
Сега следвайте пример за това как се извършва изчисляването на решение с неизвестна моларност.
1-ви) 30 ml неизвестен основен разтвор се добавят към колба на Erlenmeyer, за да се извърши титруване, за да се определи неговата концентрация (моларност). Към бюретата се добавят 50 ml от 0,2 mol / L концентратен разтвор на киселина. След изпускане на киселинния разтвор и докато основният разтвор се титрува, се наблюдава, че при титруването се използват 20 ml от киселинния разтвор. Определете моларността на използвания основен разтвор.
Данни за упражнения:
Vb = 30 ml
Mb =?
Ma = 0,2 mol / L
Va = 20 ml
Тъй като моларността на киселината и нейният обем са съответно 0,2 mol / L и 20 ml, а обемът на използваната основа е 30 ml, просто използвайте формулата за титруване:
Ma.Va = Mb.Vb
0.2.20 = Mb.30
4 = Mb.30
4 = Mb
30
Mb = 0,133 mol / L
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/analise-volumetrica.htm
