Органичните съединения са молекулни, тоест техните атоми носят ковалентни връзки помежду си. Когато анализираме връзките между въглеродните атоми, които могат да бъдат единични, двойни или тройни, ние забелязваме, че те са неполярни връзки, тъй като няма разлика в електроотрицателността между атомите, тъй като те принадлежат към едни и същи елемент.
Освен това, тъй като водородът и въглеродът имат много малка разлика в електроотрицателността, връзките между тях също са неполярни.
Неполярни връзки:
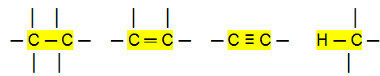
С това можем да заключим, че Въглеводороди (органични съединения, които имат само въглеродни и водородни атоми) са неполярни молекули. В тези съединения междумолекулното взаимодействие е от индуциран тип дипол, който е най-слабото, което съществува.
Тъй като са слаби, тези взаимодействия лесно се прекъсват. Поради това, температурите на кипене и топене на въглеводородите са по-ниски от тези на другите функции.

Сравнявайки въглеводородите, точките на кипене ще се увеличават с увеличаване на моларната маса.
Например етанът и бутанът са и двата алкана. Вижте точките на кипене на всеки експериментално определен:
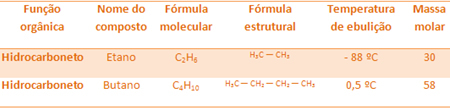
Имайте предвид, че температурата на кипене на бутан е много по-висока от тази на етана, тъй като неговата моларна маса също е по-висока.
Сега, когато сравняваме въглеводороди, които имат еднаква моларна маса (те са изомери), но които имат различни видове въглеродни вериги, ние осъзнаваме, че колкото по-голям е броят на клоните, толкова по-ниска е температурата на кипене, тъй като структурата на молекулата става по-компактна, тоест повърхността й намалява.
Всички алкани по-долу имат една и съща молекулна формула, С5Н12, но температурите им на кипене са различни:
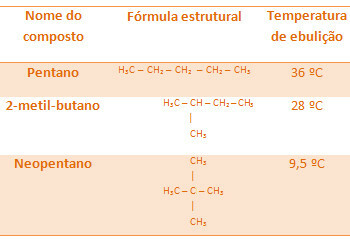
Имайте предвид, че температурата на кипене на неопентан е най-ниската, тъй като има повече разклонения.
Можем да считаме, че другите органични функции се получават от въглеводороди, чрез заместване на един или повече водорода с атоми или групи атоми на други елементи. Обикновено другите органични функции имат кислород или азот, които са по-електроотрицателни елементи от въглерода. Те привличат по-силно двойката електрони, споделени с въглерод и следователно правят молекулата полярна:
Полярни връзки:
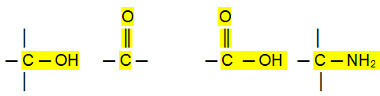
Алдехидите, кетоните и органичните халогениди имат по-високи точки на кипене от въглеводороди, тъй като тяхното междумолекулно взаимодействие е постоянният дипол, който е по-силен от този на индуциран дипол.
Алкохолите, карбоксилните киселини и амините, от друга страна, имат дори по-високи температури на кипене, тъй като осъществяват водородни връзки, най-интензивният тип междумолекулно взаимодействие.
В съединенията с всички тези функции се прилага същото, както видяхме за въглеводородите:

От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/polaridade-temperatura-ebulicao-dos-compostos-organicos.htm
