Някои съединения имат в структурата си двойни връзки, редуващи се с единични връзки. Най-известният от тях е бензенът, чиято структура е предложена през 1865 г. от германския химик Фридрих Август Кекуле (1829-1896). Неговата структура ще бъде циклична и образувана от три двойни връзки, осеяни с три единични връзки, както е показано на фигурите по-долу:
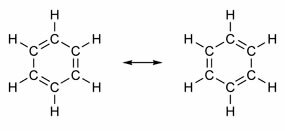
И двата начина за представяне на бензола са приемливи, тъй като е възможно да се променят електроните в π връзките, без да се променя положението на атомите. Нито пък представя точно това, което е, нито обяснява поведението си. То трябва да се държи като алкен и да предизвиква реакции на добавяне, но на практика това не се случва. Бензенът е доста стабилен и действа така, сякаш няма двойни връзки; той дава реакции на заместване като при алкани.
През 1930 г. американският учен Линус Полинг предлага теорията за резонанса, която обяснява това очевидно противоречие. Тази теория казва:
„Винаги, когато в структурна формула можем да променим позицията на електроните без промяна на позицията на атомите, реалната структура не няма да бъде нито една от получените структури, а по-скоро a резонансен хибрид на тези структури. "
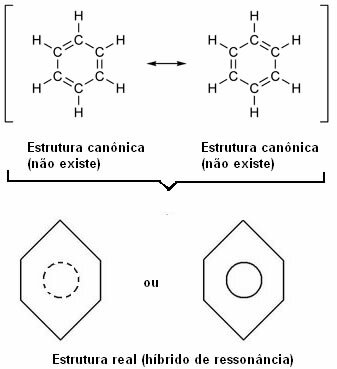
Този ефект се доказва от размера на въглеродните връзки и разстоянието между тях. Това разстояние е междинно с това на единичната връзка (1,54 Å) и тази на двойната връзка (1,34 Å); следователно е 1,39 Å, поради резонансния ефект.
Този ефект може да се види и в структурата на озоновата молекула (O3), както е показано по-долу:
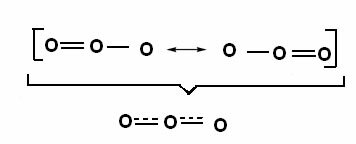
Канонични структури и озонорезонансни хибриди.
От Дженифър Фогаса
Завършва химия
Училищен отбор на Бразилия.
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm
