Въглеводороди, наричани още водородни карбиди, са органични съединения, чийто състав има само атоми от въглерод (C) и от водород (Н), като по този начин има общата формула СхЗ.у.
Въглеводородът се състои от въглеродна структура, към която се свързват водородните атоми ковалентна връзка.
Това е най-важното съединение в органичната химия.
Всички видове въглеводороди лесно се окисляват, като по този начин отделят топлина. Повечето от тях не са водоразтворими.
Природните въглеводороди са химични съединения, образувани вътре в Земята (на повече от 150 км от дълбочина) при високо налягане и достигане на зони с по-ниско налягане чрез геоложки процеси.
Къде се намират въглеводороди?
Основният източник на въглеводороди е нефтът. Поради това въглеводородът присъства в няколко производни като керосин, парафин, природен газ, Бензин, Вазелин, дизел, LPG (Втечнен петролен газ), полимери (като пластмаса и гума), наред с други.
Това органично съединение представлява 48% от енергийната матрица на Бразилия.
Въглеродната верига, която съставлява част от състава на въглеводорода, е
четиривалентен, тоест може да направи четири връзки.Въглеродът е способен да се свързва с други въглеродни атоми и с водород чрез прости връзки, удвоява или тройни.
Класификация на въглеводородите
Класификацията на въглеводородите се основава на три особености: a форма на основната въглеродна верига, Връзки на въглеродните вериги, наличие на алкилови радикали във въглеродната верига и наличие на хетероатоми разделяне на въглеродната верига.
знам повече за водород.
Основна форма на въглеродна верига
По отношение на формата на основната въглеродна верига класификацията на въглеводородите е подразделена на алифатен и цикличен.
Проверете от какво се състои всяка от тези форми на въглеродна верига.
алифатни въглеводороди
Алифатните въглеводороди се образуват от въглеродни вериги отворен или ацикличен. В тези вериги въглеродите са терминали.
Примери:
алкан
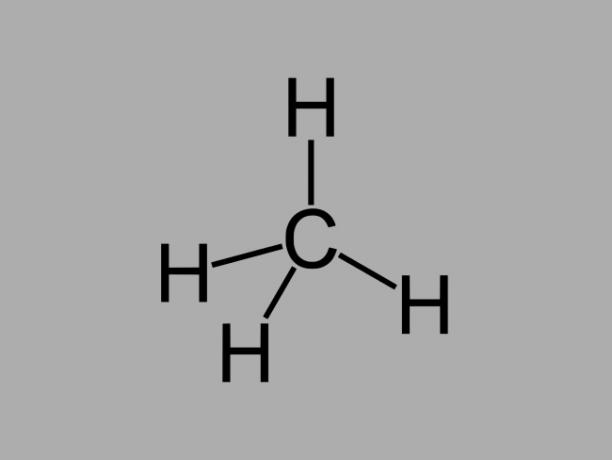
Алканови въглеводороди, наричани още парафини или парафинов, са маслени съединения, при които между въглеродите има само единични връзки.
Общата формула за алкан е СнеН2не + 2 (n = всяко цяло число).
алкен
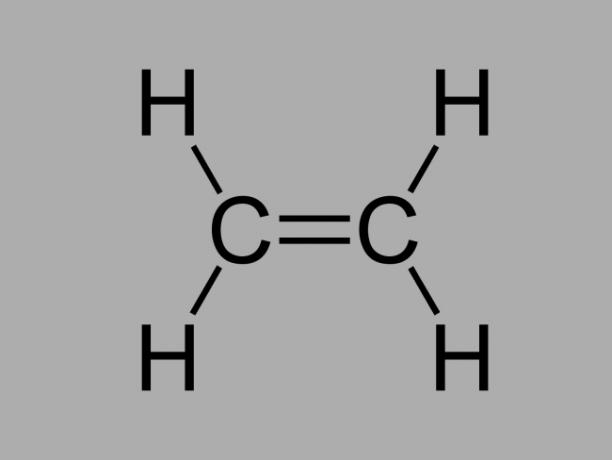
Също наричан олефин, алкен или етиленов въглеводород, алкенът е слабо реактивно съединение, където има двойна връзка между въглеродните атоми.
Общата формула за алкен е СнеН2не.
алкин
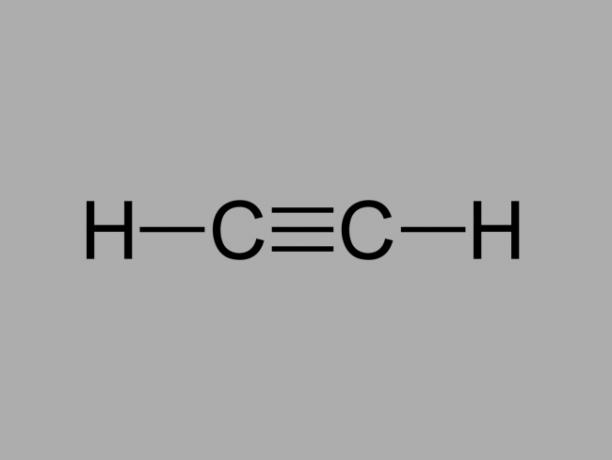
Също наричан метилацетилен, алкинът е въглеводород, където съществуващите връзки между въглеродните атоми са тройни.
Общата формула за алкин е СнеН2не-2.
алкадиен

Наричани още диени или диолефини, алкадиените са въглеводороди, при които връзките между въглеродите са двойни.
Общата формула за алкадиен е СнеН2не-2.
Циклични въглеводороди
Цикличните въглеводороди се образуват от затворени или циклични въглеродни вериги. Тези вериги нямат крайни въглероди.
Примери:
Циклан
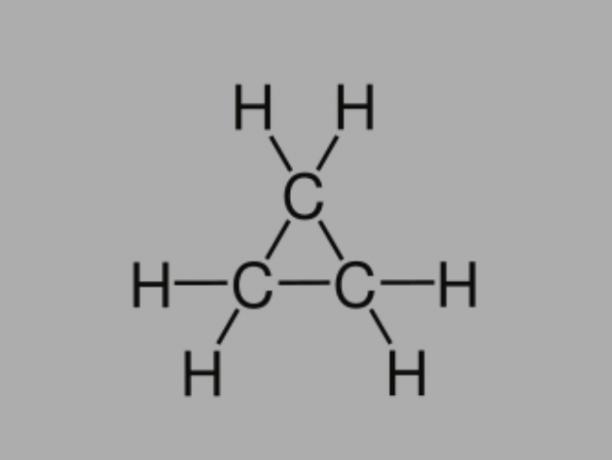
Също наричан циклоалкан, циклопарафин или нафтенов въглеводород, цикланът е наситен въглеводород, съставен от единични връзки.
Той има затворена въглеродна верига и общата му формула е CнеН2не.
Циклонична

Също наричан циклоалкени, циклоните са ненаситени въглеводороди, съставени от двойни връзки.
Cyclene има затворена въглеродна верига и неговата обща формула е CнеН2не−2.
колоездач
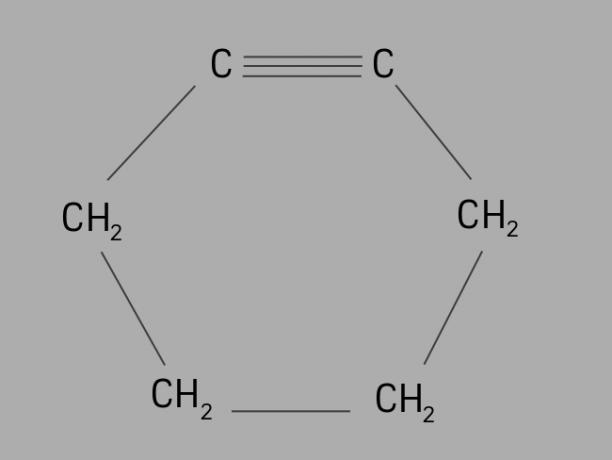
Също наричан циклоалкин или циклоалкин, циклинът е цикличен и ненаситен въглеводород.
Образува се от затворена въглеродна верига, с тройни връзки и общата му формула е СнеН2не-4.
Ароматен

или

Също наричан арени, ароматните въглеводороди са ненаситени съединения, образувани от двойни връзки.
Ароматът има затворена или циклична въглеродна верига и неговата обща формула е С6З.6.
Тип свързване на въглеродни вериги
В зависимост от вида на връзката на въглеродните вериги, въглеводородите могат да бъдат класифицирани наситени или ненаситен.
Вижте по-долу от какво се състои всяка от тези класификации.
Наситени въглеводороди
Наситените въглеводороди се образуват от прости връзки.
Примери: алкани, циклани.
ненаситени въглеводороди
Ненаситените въглеводороди се образуват от двойни връзки или тройни.
Примери: алкени, алкини, алкадиени.
Наличие на алкилови радикали
Що се отнася до наличието на алкилови радикали, въглеводородите могат да имат въглеродна верига нормално или разклонени.
нормална въглеродна верига
Нормалният въглеводород на въглеродната верига няма алкилови радикали.
Пример: пентан
разклонена въглеродна верига
Когато въглеводородът има разклонена въглеродна верига, това означава, че основната му въглеродна верига има алкилови радикали.
Пример: метилпропан
Наличие на хетероатоми, разделящи въглеродната верига
Последователната въглеродна верига може или не може да бъде разделена в зависимост от наличието на хетероатоми.
Хомогенна въглеродна верига
Когато въглеводородът има хомогенна основна въглеродна верига, това означава, че тази верига не е разделен от хетероатоми.
Хетерогенна въглеродна верига
Ако въглеводородът има хетерогенна основна въглеродна верига, тази верига е имала своите разделена въглеродна верига от хетероатом.
Номенклатура на въглеводородите
Номенклатурата на въглеводородите се определя чрез комбинация от три части:

Префиксът идентифицира количеството въглероди, междинният - вида на връзката, а суфиксът показва функцията, към която принадлежи съединението (в този случай класът на въглеводородите).
Вижте по-долу списъка с представки и междинни продукти, които се комбинират за обозначаване на въглеводороди.
Префикс списък
| Брой въглероди | Префикс |
|---|---|
| 1 | Met- |
| 2 | Et- |
| 3 | Проп- |
| 4 | Но- |
| 5 | пент |
| 6 | Шестнадесетичен |
| 7 | Хепт- |
| 8 | Октомври- |
| 9 | Не- |
| 10 | Дек- |
Списък на посредниците
| Вид на връзката | Посредник |
|---|---|
| Само единични разговори | -ан- |
| Сдвояване | -ен- |
| тройна | -в- |
| две двойки | -диен- |
Погледнете някои примери за именуване на въглеводороди.
Примери:
CH3 - СН2 - СН2 - СН3
В горната структурна форма можем да видим 4-въглеродно съединение, което има само единични връзки (обозначени със символа „-“).
- Префикс за 4 въглерода = но-
- Междинно за единично свързване = -an-
- Суфикс на въглеводород = -o
Вижте, че съюзът на префикс + междинен + суфикс поражда името БУТАН.
CH2 = СН2
Структурната форма по-горе има 2 въглерода и 1 двойна връзка (обозначена със символа „=“).
- Префикс за 2 въглерода = et-
- Междинно за двойни връзки = -en-
- Суфикс на въглеводород = -o
Вижте, че съюзът на префикс + междинен + суфикс поражда името ЕТЕН.
CH2 = СН - СН2 - СН3
CH3 - СН = СН2 - СН3
Имайте предвид, че и двете от горните структурни форми имат 4 въглерода и 1 двойна връзка (обозначена със символа "=").
По този начин имаме:
- Префикс за 4 въглерода = но-
- Междинно за двойни връзки = -en-
- Суфикс на въглеводород = -o
Вижте, че съюзът на префикс + междинен + суфикс би породило името БУТЕН за двете структурни форми.
Имайте предвид обаче, че структурните форми не са идентични, така че номенклатурите не могат да бъдат и двете.
Разликата между двете структурни форми се крие в местоположението на двойната връзка.
В този случай трябва да номерираме въглеродите във веригата от края, най-близък до двойника. Следователно във въпросните случаи трябва да броим отляво надясно.
В CH2 = СН - СН2 - СН3:
- CH2 ще бъде 1
- СН ще бъде 2
- CH2 ще бъде 3
- CH3 ще бъде 4
Имайте предвид, че двойна връзка е между въглерод 1 това е въглерод 2.
Трябва да използваме най-малкото число (1), за да намерим двойната връзка: БУТЕН -1
В CH3 - СН = СН2 - СН3:
- CH3 ще бъде 1
- СН ще бъде 2
- CH2 ще бъде 3
- CH3 ще бъде 4
Обърнете внимание, че двойната връзка е между въглерод 2 това е въглерод 3.
Трябва да използваме най-малкото число (2), за да намерим двойната връзка: БУТЕН -2
Според IUPAC (Международен съюз за чиста и приложна химия - Международен съюз за чиста и приложна химия), местоположението трябва да бъде посочено малко преди разположени (в случая на структурните формали по-горе, двойната връзка, представена от междинната “-En-”).
С това имаме втори начин, който между другото е най-правилният, да напишем номенклатурата на наличните структурни форми.
CH2 = СН - СН2 - СН3: BUTENE -1 или BUT-1-ENO (по-правилна форма)
CH3 - СН = СН2 - СН3: BUTENE -2 или BUT-2-ENE (по-правилна форма)
Научете повече за IUPAC и номенклатура.


