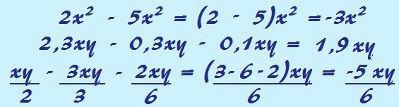Изомеризъм това е естествен феномен, при който различните вещества (по отношение на химични и физични свойства) имат абсолютно същата молекулна формула, както в следващия пример:
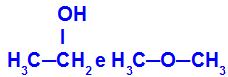
Различни вещества, които имат еднаква молекулна формула
Етанолът (вляво) има молекулната формула С2Н6O, което се среща и с метоксиетан (вдясно), така че те са изомери.
Видове изомеризъм
→ плосък изомер
Видът на изомерия е този, който изучава структурните разлики между изомерите.
The) Професия
Това е видът на плоска изомерия, при който разликата между веществата се основава на разликата между органичните функции, към които принадлежат. Вижте няколко примера:
Пропанон и пропан:
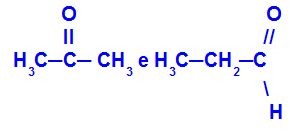
Изомери, принадлежащи към различни функции
Пропанонът (вляво) принадлежи към кетонната група, а пропаналът (отдясно) принадлежи към алдехидната група.
Б) Затвор
Това е видът на плоска изомерия, при който разликата между веществата се основава на разликата между веригите, които те представят. Вижте пример:
2-метил-пропан и бутан
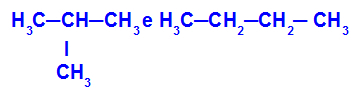
Изомери, които имат вериги с различни класификации
В примера можем да видим, че 2-метил-пропанът (отляво) има разклонена верига, а бутанът (отдясно) има нормална верига.
° С) Позиция
Това е видът на плоска изомерия, при който разликата между веществата се основава на разликата в позицията на даден компонент, присъстващ в техните вериги. Вижте пример:
1-хлоро-пропан и 2-хлоро-пропан
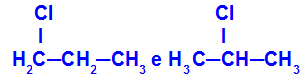
Изомери, които имат компоненти на различни позиции във веригата
В примера можем да видим, че 1-хлоро-пропанът (отляво) има хлор, позициониран върху въглерод 1, а 2-хлоро-пропанът (отдясно) има хлор, позициониран върху въглерод 2.
д) Метамерия или компенсация
ЗАБЕЛЕЖКА: Изомеризъм, валиден изключително за разнородни струни.
Това е видът на плоска изомерия, при който разликата между веществата се основава на разликата в позицията на хетероатом, присъстващ в техните вериги. Вижте пример:
Пример: Метоксипропан и етоксиетан
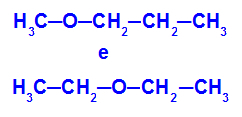
Изомери, които имат хетероатоми на различни позиции във веригата
В примера можем да видим, че в метоксипропан (вляво) кислородът има радикал с един въглерод от едната страна и три въглерода от другата. В етоксиетана (вдясно) кислородът има радикал с два въглерода от едната страна и два въглерода от другата.
и)Тавтомерия
Това е частен случай на изомерия на равнинната функция и се среща само в три органични функции:
Алдехид
кетон
Енол
Този тип изомерия работи върху факта, че съществува химичен баланс между енол и алдехид и между енол и кетон, т.е. тези компоненти непрекъснато се превръщат един в друг. Вижте пример:
Prop-2-en-1-ol и пропанон
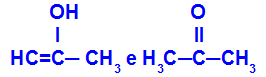
Изомери, принадлежащи към различни функции
В примера можем да видим, че Prop-2-en-1-ol (отляво) принадлежи към групата на енолите, а пропанонът (отдясно) към групата на кетоните, така че те са изомери на тавтомерията.
→ Космическа изомерия
Това е вид изомерия, дефинирана от пространствения анализ на молекулата.
а) Геометрични изомери
Не спирайте сега... Има още след рекламата;)
Това е вид пространствена изомерия, която възниква, когато веществото има молекули със следните характеристики:
Затворена верига, която има два въглерода с два различни лиганда, както в примера по-долу:

Затворена структура с геометрична изомерия
Отворена верига, която има двойна връзка между въглеродите и във всеки от тези въглероди от двойната връзка има два различни лиганда, както в примера по-долу:
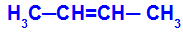
Отворена структура с геометрична изомерия
Геометричната изомерия е разделена на две групи:
1О Група: цис-транс
Това се случва, когато двата лиганда на един въглерод са строго равни на двата лиганда на другия въглерод, независимо дали в отворена структура или в затворена структура.
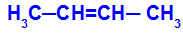
Верига от вещество, което има цис-транс изомерия
Изомерът ще се нарича cis, когато същите лиганди са в една и съща равнина.

Пример за цис изомер
Изомерът ще се нарича транс, когато различните лиганди са в една и съща равнина.

Пример за транс изомер
2О Група: E-Z
Това се случва, когато двата лиганда на единия въглерод са различни по отношение на двата лиганда на другия въглерод, било то в отворена структура или в затворена структура.

Верига от вещество, което има E-Z изомеризъм
Изомерът ще се нарича Е, когато лигандите с най-голям атомен номер са в противоположни равнини. В примера по-долу въглеродът отляво има Br с най-висок атомен номер (35), а в другия има кислород (8).
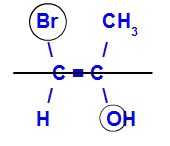
Пример за Е-изомер
Изомерът ще се нарича Z, когато лигандите с най-голям атомен номер са в една и съща равнина. В примера по-долу въглеродът отляво има Br с най-висок атомен номер (35), а в другия има кислород (8).

Пример за Z-изомер
Б) оптичен изомер
Това е вид пространствена изомерия, която се появява само ако веществото има молекули с хирален въглерод (този, който има четири различни лиганди) в техните структури. Молекулата с хирален въглерод има способността да поляризира и отклонява светлината, както следва:
Вдясно (десен изомер)
Вляво (левовъртящ се изомер)
Съединение с оптична активност винаги има активни изомери (наречени оптични антиподи) и неактивни изомери (смес между два активни изомера, смес, наречена рацемична).
Можем да използваме следната формула, за да определим броя на активните (IOA) и неактивни (IOI) изомери на съединение, което има хирален въглерод:
IOA = 2не
IOI = 2не
2
По-долу е даден пример за съединение, което има геометрична изомерия:
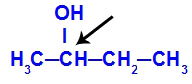
Хирален въглерод, представен в бутан-2-ол
Структурата на бутан-2-ола има следните лиганди:
Метил (СН3)
Етил (СН3-CH2)
Водород (H)
Хидроксил (OH)
Тъй като има само един хирален въглерод, тогава бутан-2-олът има:
Активни изомери:
IOA = 21
IOA = 2
Неактивни изомери:
IOI = 21
2
IOI = 2
2
IOI = 1
От мен Диого Лопес Диас
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
ДНИ, Диого Лопес. „Какво е изомерия?“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria.htm. Достъп на 27 юни 2021 г.