НА уравнение на клапейрон е математически израз, който свързва величини като натиск (P), обем (V), температура (T) и брой частици (n), които съставляват a перфектен или идеален газ. Това уравнение е кръстено на френския физик Павелemileклапейрон и може да се разбере като обобщение на емпиричните закони на газовеперфектновГей-Лусак, Чарлз и Бойл. Той е бил основен за изследването на идеалните газове и е позволил еволюцията на Термични машини, което ги прави все по-ефективни през последните няколко десетилетия.
Вижте също: Физически открития, станали вследствие на злополука
Уравнението на Клапейрон: закон за идеалния газ
Уравнението на Клапейрон е извлечени от три емпирични закона, тоест закони, които са определени от експерименти. Такива закони обясняват поведението на газовете в газови трансформацииизоволуметричен (Закон за гей-Лусак), изобарен (Закон на Чарлз) и изотерми (Законът на Бойл). Според тези закони:
в трансформациите изоволуметричен, съотношението между налягането и термодинамичната температура на идеалния газ остава постоянно;
в трансформациите изобарен, съотношението между обема и термодинамичната температура на идеалния газ е постоянно;
- в трансформациите изотерми, произведението на налягането и обема на идеалния газ остава постоянно.
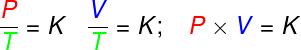
P - налягане (Pa - паскал)
V - обем на газа (m³)
T - термодинамична температура на газа (K - келвин)
От трите закона по-горе уравнението на Клапейрон определя каква е стойността на това постоянна (К) получени във всяка от гореспоменатите трансформации. Според уравнението на Клапейрон тази константа е равна на броя на бенките, умножен по a константа R, известна като универсална константа на идеални газове и равна на Константа на Болцман умножено по Номер на Авогадро.
Формула
Вижте формулата, която е известна като уравнениевКлапейрон:
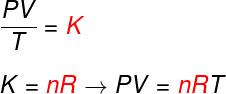
не - брой молове (mol)
R - универсална константа на идеални газове (R = 0,082 атм. Л / мол. K или 8,314 J.mol / K)
Анализирайки уравнението на Клапейрон, е възможно да се види, че натиск упражнявани от идеални газове е право пропорционални на температурата а също и да брой бенки. Освен това, налягането е обратно пропорционално на обема заети с газ.
Не спирайте сега... Има още след рекламата;)
О идеален газов модел възможно чрез уравнението на Клапейрон се използва широко за разработване на машини, задвижвани от течности, като машини с парово захранване и двигатели с вътрешно горене.
Няколко важни резултата могат да бъдат получени от уравнението на Клапейрон. Един от тях, например, прогнозира, че 1 мол от всеки идеален газ заема обем от 22,4 л когато е подложен на натиска на 1 атм (1,01.105 Pa) и при температура от 273 000 (0 ° С).
Вижте също: Най-важните понятия в термологията
Решени упражнения по уравнението на Клапейрон
Въпрос 1 - (UECE) Газ, който може да има своята температура, обем и налягане, свързани с PV = nRT, има следните характеристики:
а) много голямо средно разстояние между молекулите, за да се пренебрегнат междумолекулните взаимодействия, освен при сблъсък; молекулите претърпяват еластични сблъсъци.
б) много малко средно разстояние между молекулите; молекулите претърпяват нееластични сблъсъци.
в) много голямо средно разстояние между молекулите, за да се пренебрегнат междумолекулните взаимодействия, освен при сблъсък; молекулите претърпяват нееластични сблъсъци.
г) много голямо средно разстояние между молекулите и със силни междумолекулни взаимодействия; молекулите претърпяват еластични сблъсъци.
Резолюция:
В модела на идеалния газ голям брой безразмерни частици се движат с висока скорост в произволни посоки. Единственото взаимодействие, претърпяно от тези частици, са идеално еластични сблъсъци, така че правилната алтернатива е буква а.
Въпрос 2 - (UFRGS) Обмислете следните твърдения за идеалните газове.
I. Константата R, присъстваща в уравнението на състоянието за газове pV = nRT, има еднаква стойност за всички идеални газове.
II. Равни обеми от различни идеални газове при една и съща температура и налягане съдържат еднакъв брой молекули.
III. Средната кинетична енергия на молекулите на идеален газ е право пропорционална на абсолютната температура на газа.
Кои са верни?
а) Само аз
б) Само II
в) Само III
г) Само I и II
д) I, II и III
Шаблон:
Нека разгледаме алтернативите:
I. правилно, затова се нарича универсална константа на идеалните газове.
II. правилно. Според уравнението на Клапейрон, ако два идеални газа имат еднакво налягане, температура и обем, тогава броят на частиците в тези газове е равен.
III. правилно. Съгласно теоремата за енергийното равнопоставяне, кинетичната енергия на частиците в идеален газ е пропорционална на неговата температура.
Следователно, правилната алтернатива е буква д.
Въпрос 3 - (UFJF) Мъже като Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, наред с други, са разработили важни изследвания, включващи свойствата на газовете. Поведението на реалните газове се доближава до идеални газове при условия на ниско налягане, както и до газове, съдържащи се в голям обем, и газове, задържани при високи температури. Помислете, че при лабораторен експеримент контейнер с обем V е напълно затворен и съдържа 1 mol идеален газ под налягане 4,0 atm се подлага на разширение при постоянна температура, равна на 127 ° C и че поведението на този газ е като на идеален газ, както е показано в графичен.
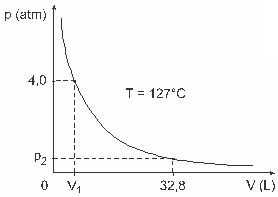
В този случай, когато газът заема обем, равен на 32,8 L, налягането, упражнявано от него, ще бъде:
(Като се има предвид: универсалната константа на перфектните газове е R = 0,082 атм. L / mol. К.)
а) 0,32 атм
б) 0,40 атм
в) 1,0 атм
г) 2,0 атм
д) 2,6 атм
Резолюция:
Писмо В.
За да решим упражнението, трябва да приложим данните към уравнението на Клапейрон, но преди това трябва да трансформираме температурата, която е в градуси по Целзий, в келвин. Разгледайте:

От Рафаел Хелърбок
Учител по физика


