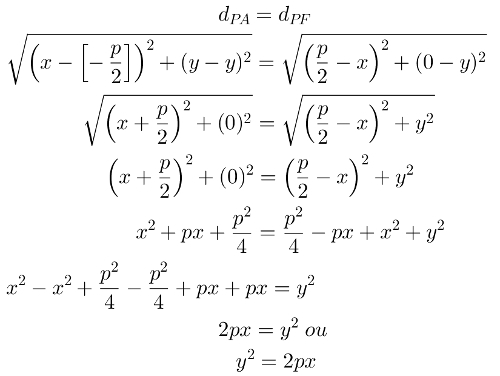НА Свързваща енергия е замесен в почивкатаилив тренировка на една или повече връзки между атоми на молекула. Молекулата на водородния газ, например, има единична връзка (сигма) между участващите атоми:

Структурна формула на водороден газ
За да е възникнала тази молекула, се е образувала единичната връзка между нейните атоми. Когато тази молекула участва в химическа реакция с хлорен газ (Cl2), например, за образуването на солна киселина (HCl), единичните връзки, присъстващи в Н2 и в Cl2 трябва да се скъса с последващото образуване на единична връзка в HCl.

Представяне на разкъсването на единични връзки в реагента и образуване на единична връзка в продукта
Атомите се свързват, за да постигнат своето електронна стабилност, тоест те преминават от по-висока енергийна ситуация към по-ниска енергийна ситуация. По този начин можем да кажем, че когато се образува връзката между атомите, енергията се освобождава; следователно неговото разпадане зависи от усвояването на енергия.
Ако разберем това раздялата
(разкъсване) на химическа връзка възниква, когато тя е подадена към нея количество енергия (xKcal), стигнахме до заключението, че това е процес ендотермичен. За разлика от това, образуването на връзка ще включва освобождаване дава същото количество енергия (-xkcal), бидейки тогава процес екзотермичен.като химичните реакции се класифицират в ендотермична или екзотермична, можем да използваме знания за енергиите на свързване на молекулите на реагентите и продуктите, за да определим изменението в енергията (ΔH) на химичния процес и след това да го класифицираме.
Например вижте уравнението по-долу:

Химически облигации в участници в химическо уравнение
Имаме прости връзки във всеки от участниците в реакцията. Те имат следните стойности:
[A-B] = 50 Kcal
[CD] = 100 Kcal
[B-D] = 80 Kcal
[Пр.н.е.] = 230 Kcal
Със стойностите по-горе можем да изчислим енергията, участваща в разкъсването на връзките на реагентите и образуването на връзките на продукти, както следва:
В реагенти
50 Kcal за прекъсване на AB връзката и 100 Kcal за прекъсване на CD връзката, т.е. в реагента, 150 Kcal ще бъдат използвани за разкъсване на връзките.
В продукти
80 Kcal за образуване на BD връзка и 230 Kcal за образуване на AC връзка, т.е. 310 Kcal ще се отделят в продукта при образуване на връзки
Със стойностите на енергиите, участващи в реагентите и продуктите, е възможно да се разбере дали реакцията е абсорбирала или освобождава повече енергия само чрез изваждане на енергията, използвана при разрушаването, от енергията, освободена в формиране:
ΔН = Енергия на реагентите - Енергия на продуктите
ΔН = 230 - 310
ΔН = -80 Kcal
Не спирайте сега... Има още след рекламата;)
Тъй като реакцията има повече енергийно освобождаване, отколкото абсорбция, отрицателният ΔH е екзотермичен.
ЗАБЕЛЕЖКА: Ако стехиометричният коефициент на участника е различен от 1, трябва да умножим енергийната стойност на връзката по коефициента, например:

Уравнение за образуване на HCl
Тъй като коефициентът на HCl е 2, трябва да умножим стойността на свързването на HCl с 2.
Сега следвайте резолюцията на упражнение за свързваща енергия в химична реакция:
Пример: Като се имат предвид следните енергии на свързване, в килоджаули на мол връзки (абсолютни стойности):
Н - Н = 436
N ≡ N = 945,6
N - H = 391
Изчислете топлината (в килоджаули на мол NH3 (g)) участва в реакцията, представена от:

Химични връзки в реакцията на образуване на NH3
Резолюция:
Първата стъпка в решаването на това упражнение е да се пренапише предоставеното уравнение, демонстриращо химичните връзки, налични във всяка от молекулите:
Не N2: имаме тройна връзка (тъй като N, семейството на азота, трябва да направи три връзки, тъй като има пет електрона във валентната обвивка);
в Н2: Имаме единична връзка (тъй като Н трябва да направи само една връзка, защото има само един електрон във валентната обвивка);
в NH3: Имаме присъствието на три прости връзки (защото всяко Н се нуждае от връзка, а N, три връзки).

Уравнение, демонстриращо връзките в образуването на NH3
Тъй като упражнението предоставя стойностите за всяко свързване, първата стъпка е да се определи енергията на свързване, свързана с всеки от участниците:
- към N2
Ние имаме 1 мол в н2в уравнението и, за да прекъснем връзката ви, се нуждаем от 945,4 KJ, следователно:
1.945,4 = 945,4 KJ
- До H2
Ние имаме 3 mol в З.2в уравнението и, за да прекъснем връзката ви, се нуждаем от 436 KJ, следователно:
3.346 = 1038 KJ
- Към NH3
Ние имаме 2 mol NH3в уравнението, но има три пъти N-H връзката, така че нека умножим количеството енергия, свързано за образуването на тази връзка по 2 и по 3:
2.3.391 = 2346 KJ
И накрая, можем да определим топлината, участваща в реакцията, като извадим енергията, използвана за разбиване на реагента, от енергията, отделена при образуването на продукта:
ΔH = енергия в реагентите - енергия в продуктите
ΔН = (945,4 + 1038) - 2346
ΔН = 1983.4 - 2346
ΔН = - 362,6 KJ на мол NH3 (g)
Тъй като вариацията е отрицателна, това означава, че енергията, освободена при образуването на връзки в продуктите, е била по-голяма от енергията, погълната при разкъсване на връзките на реагентите, следователно, реакцията е екзотермична.
От мен Диого Лопес Диас