Когато говорим за рН, ние се позоваваме на хидрогенния потенциал на разтвора, т.е. количеството хидрониеви катиони (H+ или Н3О+), които са диспергирани в разтворител на разтвор.
Хидрониевите катиони са добре известни поради дефиницията, предложена от учения Архений за киселина. Този учен твърди, че киселина е способно всяко вещество йонизира и произвеждат хидрониеви йони във водна среда.
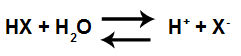
Уравнение за киселинна йонизация
съкращението рН служи като еталон за определяне на нивото на киселинност на дадена среда. Въпреки това, дълго време химиците също са използвали рН като справка, за да се определи освен киселинността дали дадена среда е основна или неутрална.
Това е възможно, тъй като химиците вече са наясно, че водата се подлага на самойонизация, т.е. произвежда хидронии (H+) и хидроксиди (OH-). По този начин, водният разтвор никога няма само хидроний или хидроксид, но и двете, както можем да видим от следното уравнение:

Уравнение за автоионизация на водата
Стойности, използвани като еталон за pH
Стойностите, използвани за рН се отнасят до йонизационната константа (Kw) на вода при температура 25ОC, което е равно на 10-14. При тази температура концентрациите на хидрониеви и хидроксидни йони, произведени от водата, са абсолютно равни, т.е. 10-7 mol / L.
[H+] = [ОН-]= 10-7
От тази справка използваните стойности за рН варират от 0 до 14.
Формули за изчисляване на рН
а) Изчисляване от концентрацията в мол / L на хидрониеви катиони
Изчисляването на стойността на рН може да се направи директно, стига да знаем концентрацията на хидрониите ([H+]). Виж:
pH = -log [H+]
или
10-pH = [Н+]
б) Изчисляване от концентрацията на хидроксидни аниони (OH-)
pOH = -log [OH-]
или
10-pOH = [ОН-]
След като изчислите стойността на pOH, трябва да я използвате в следващия израз, за да определите стойността на pH.
pH + pOH = 14
Тълкуване на стойностите на pH
Познавайки стойността на рН, можем да определим дали въпросният разтвор има киселинен, основен или неутрален характер. За да направите това, просто използвайте следната схематична връзка:
За стойности на pH под 7 = кисела среда;
За рН със стойност, равна на 7 = неутрална среда;
За стойности на pH над 7 = основна среда.
Примери
1-ви пример: Знаейки, че концентрацията на хидрониеви катиони в разтвор е 2.10-4 mol / L, каква трябва да е стойността на рН на този разтвор?
За да се определи стойността на рН на разтвора от концентрацията на хидронии (H+), 2.10-4 mol / L, трябва да използваме следния израз:
pH = -log [H+]
pH = -log [2.10-4 ]
pH = - (log 2 + log 10-4)
pH = -log2 - log10-4
pH = –log 2 - 4.log 10
рН = –0,3 + 4. (1)
рН = -0,3 + 4
рН = 3.7
2-ри пример: Разтворът, образуван от определено разтворено вещество, има концентрация на хидроксидни йони, равна на 10-11 mol / L. От тази концентрация можем да кажем, че рН на този разтвор струва колко?
За да се определи стойността на рН на разтвора от концентрацията на хидроксид, 10-11 mol / L, трябва да направим следното:
1О Стъпка: изчислете стойността на pOH.
10-pOH = [ОН-]
10-pOH = 10-11
Трябва да умножим израза по -1, защото pOH винаги е положително неизвестно.
-pOH = -11. (- 1)
pOH = 11
2О Стъпка: изчислете стойността на рН.
pH + pOH = 14
рН + 11 = 14
рН = 14 - 11
рН = 3
От мен Диого Лопес Диас
Източник: Бразилско училище - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm
