НА формация енталпия, също наричан стандартна енталпия на образуването, или стандартна топлина на образуване, е изчисляването на топлината, отделена или абсорбирана при образуването на 1 мол вещество от прости вещества, в стандартно състояние.
Невъзможно е да се изчисли абсолютната стойност на енталпиите на всяко вещество, но е възможно да се изчисли вариацията в енталпията, която възниква в реакцията с помощта на калориметър.
Необходимо е да се помни това беше договорено да се приеме стойността на енталпията, равна на нула, за прости вещества в стандартното състояние. По този начин, ако искаме да разберем каква е енталпията на образуването на дадено вещество, трябва само да знаем стойността на енталпията на реакцията му на образуване от прости вещества.
Например искаме да намерим енталпията от 18 грама вода, което съответства на 1 mol, тъй като нейната моларна маса е 18 g / mol. За да направите това, първо се нуждаем от реакцията, за да образуваме вода от прости вещества, както е показано по-долу:
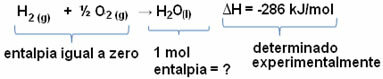
Обърнете внимание, че стойността на изменението на енталпията, настъпила в тази реакция, е експериментално определена с помощта на калориметър и е равна на -286 kJ / mol.
Формулата, която изчислява тази промяна в енталпията (ΔH), е:
ΔH = HПродукти - З.Реактиви
По този начин, тъй като вече знаем стойността на ΔH и че енталпията на реагентите е равна на нула (тъй като те са прости вещества в стандартното състояние), тогава можем да заключим че стойността на енталпия на 1 мол вода е равна на енталпийната промяна в реакцията на образуване, тъй като тя е единственият продукт на тази реакция, както е показано по-долу:
ΔH = HПродукти - З.Реактиви
-286 kJ / mol = HH2O - (HН2 + Н1/2 О2)
-286 kJ / mol = HH2O - 0
З.H2O = - 286 kJ / mol
Следователно този вид енталпия, постигната от енталпията на прости вещества в стандартното състояние, е стандартна енталпия на образуването (ΔH0).
Сега има много вещества, които не се образуват директно от една реакция, като вода. В такива случаи енталпията на образуването може да се изчисли от вариацията на енталпията на реакцията.
Например NH4Cl се образува чрез следната реакция:
NH3 + HCl → NH4Cl ΔH = -176 kJ / mol
Имайте предвид, че нито един от реагентите не е просто вещество, така че не можем да им присвоим нулева енталпия. Трябва да знаем енталпиите на образуване на всеки от реагентите, тъй като те се образуват от реакции между прости вещества:
NH3: ΔH = -46 kJ / mol
HCl: ΔH = -92,4 kJ / mol
Добавяйки тези две енталпии заедно, получаваме стойността на енталпията на реагентите и можем да намерим енталпията на NH4Cl:
З.R = НNH3 + НHCI
З.R = (-46 + (-92,4) kJ / mol)
З.R = -138,4 kJ / mol
Заместване във формулата:
ΔH = HПродукти - З.Реактиви
-176 = НNH4Cl - ( -138,4)
З.NH4Cl = - 176 - 138,4
З.NH4Cl = -314,4 kJ / mol
В този случай директно сумирахме стойностите на енталпиите на образуване на реагентите, тъй като съотношението на реакцията беше само 1 mol. Ако обаче при други реакции количеството на бенките е различно, ще е необходимо първо да се умножи енталпията на образуване на реагента по броя на бенките.
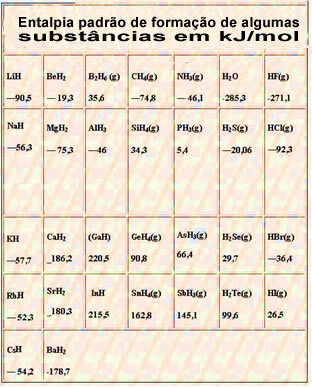
По-долу е дадена таблица със стандартната енталпия на образуване на някои вещества при 25 ° C и 1 атм:
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm

