В междумолекулни сили са тема по химия, която със сигурност може да се появи в Националния гимназиален изпит (И двете). Следователно си струва да проверите основното съдържание на тази тема в тази статия.
Определение
междумолекулни сили те са сили - с различна интензивност (слаба, средна или силна) - на електростатично привличане или връзки, установени между молекулите на веществото, които поддържат съединението между тях.
Видове междумолекулни сили
The) Индуциран дипол
И междумолекулна сила което се случва между молекули на вещество с неполярна характеристика. Това се случва например между молекули вещества като О2, H2, не2, CO2, СН4.
Съединението между тези молекули възниква, когато между тях се създаде дипол. Това се случва, когато електроните на една молекула изместват електроните на друга, като по този начин създават отрицателен и положителен полюс, който се прехвърля от една молекула в друга.
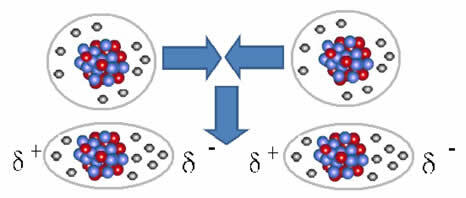
Представяне на образуването на дипол в неполярни молекули
Между тези молекули са се образували два полюса и отрицателният полюс на единия взаимодейства с положителния полюс на другия. Тъй като тези полюси са създадени, това е междумолекулна сила с ниска интензивност.
Б) постоянен дипол
И междумолекулна сила което се случва между молекули на вещество с полярна характеристика. Примери са молекули на вещества като HCN, H2О, NH3, CO, CH3Cl.
Съединението между тези молекули се случва, когато отрицателният полюс на едната взаимодейства с положителния полюс на другата.
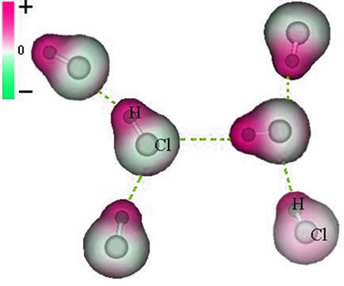
Представяне на постоянната диполна сила между молекулите на HCl
Тъй като полюсите вече съществуват, постоянната диполна междумолекулна сила е с по-голяма интензивност от индуцирания дипол.
° С) водородни връзки
Че междумолекулна сила възниква между полярни молекули, които имат водороден атом, свързан директно с кислороден, азотен или флуорен атом.
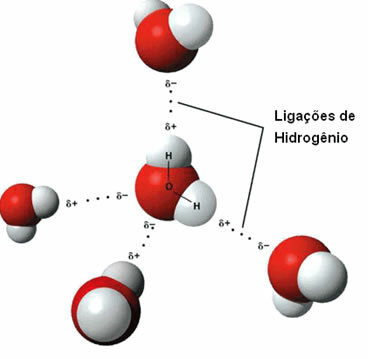
Представяне на водородните връзки между водните молекули
Водородната връзка се образува, когато водородът в едната молекула взаимодейства с кислорода, азота или флуора на другата молекула.
г) диполен йон
Тази междумолекулна сила възниква между полярна молекула, която има двойка несвързващи се електрони, и йон (катион или анион) в разтвора.
Молекулата на водата например има две двойки несвързващи електрони в кислорода. Ако във водната среда има йони, те се доближават до водната молекула, тъй като в нея има полюси.
Не спирайте сега... Има още след рекламата;)
Значение
Важността на познаването на междумолекулни сили за Енем това е разбирането, което те получават по отношение на физичните състояния, точката на топене, точката на кипене и разтворимостта на веществата.
The) Връзка с точката на топене и кипене на веществото
Точката на топене показва температурата на прехода от твърдо в течно състояние, а точката на кипене показва температурата на прехода от течно в газообразно състояние.
Този пасаж е пряко свързан с взаимодействието между молекулите на веществото, тъй като това, което различава едно физическо състояние от друго, е нивото на агрегация между неговите молекули.
По този начин, колкото по-интензивна е междумолекулната сила, толкова по-високи са точките на топене и кипене. Колкото по-малко интензивна е междумолекулната сила, толкова по-ниски са точките на топене и кипене. По този начин можем да определим низходящия ред на топене и точка на кипене:
Водородна връзка> постоянен дипол> индуциран дипол
Б) Връзка с разтворимостта
Като цяло трябва да знаем, че подобното се разтваря подобно, т.е.полярното вещество разтваря полярното вещество, а неполярното вещество разтваря неполярното вещество.
Все още обаче съществува възможност за взаимодействие между молекулите на разтвореното вещество и молекулите на разтворителя. Това се случва само ако това ново взаимодействие е по-голямо от това, което вече съществува между молекулите на самото вещество.
Пример за приложение на междумолекулна сила в Enem
1-ви пример: (Enem-2011) Човешката кожа, когато е добре хидратирана, придобива добра еластичност и мек и гладък вид. От друга страна, когато е суха, тя губи своята еластичност и изглежда непрозрачна и грапава. За да се предотврати сухота на кожата, е необходимо, когато е възможно, да се използват овлажняващи овлажнители, обикновено направени от глицерин и полиетилен гликол:

Задържането на вода върху повърхността на кожата, насърчавано от овлажнители, е следствие от взаимодействието на хидроксилните групи на омокрящите агенти с влагата, съдържаща се в околната среда чрез:
а) йонни връзки
б) Лондонски сили
в) ковалентни връзки
г) дипол-диполни сили
д) водородни връзки
Отговорът на този въпрос е водородното свързване, тъй като молекулата на водата има водородна връзка с кислороден атом. Същото се случва и с молекулите на пропилей гликол и полиетилен гликол, благоприятно условие за появата на този вид междумолекулна сила.
От мен Диого Лопес Диас
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
ДНИ, Диого Лопес. „Междумолекулни сили в Енем“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Достъп на 27 юни 2021 г.


