НА Електрохимия е клон на физическата химия, който изучава реакциите, при които има електронен трансфер (окси-редукционни реакции) и неговите преобразуване в електрическа енергия, както и обратния процес, тоест превръщането на електрическата енергия в енергия химия.
Първият процес е това, което се случва в Батерии. Батериите са устройства, образувани от два електрода (положителен полюс, който е катодът, и отрицателен полюс, който е анодът), в допълнение към електролита (проводящ разтвор). Електроните се прехвърлят от външен проводник от анода към катода, образувайки електрически ток, който се използва за включване на някакво устройство. Батериите се състоят от няколко клетки, свързани последователно или паралелно.
Това е спонтанен процес и се подава енергия до изчерпване на химическата реакция (какъвто е случаят с първични клетки и батерии, като сухата клетка на Лекланче и батерията алкална), или, в случай на обратими реакции, може да се приложи потенциална разлика и реакцията да се обърне, образувайки отново реагентите и презареждайки батерията, която той е готов да се използва отново (това е случаят с батерии и вторични батерии, като олово, използвано в автомобилите и литиево-йонно, използвано в уреди мобилни телефони).

Първични клетки и батерии на преден план, а на второ - презареждане на вторични батерии (оловен и литиев йон)
Не спирайте сега... Има още след рекламата;)
Обратният процес не е спонтанен и се нарича електролиза. Електролизата е преминаването на електрически ток, идващ от генератор, като клетка или батерия, през йонна течност. Ако течността е някакво разтопено вещество, имаме a магматична електролиза, но ако това е воден разтвор, имаме водна електролиза.
При преминаване на електрическия ток върху течната среда генераторът „издърпва“ електроните от положителния полюс (анод - той е противоположен на батерия) на електролитната клетка и ги прехвърля към отрицателния полюс (катод), т.е. катодът претърпява редукция и анодът претърпява окисление. По този начин електрическата енергия, доставяна от генератора, се трансформира в окислително-възстановителни реакции (химическа енергия). По-долу е дадена схема за електролиза на водата:
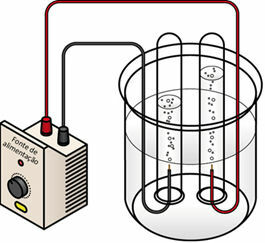
Схема за електролиза на водата
Електролизата се прилага широко индустриално при производството на важни вещества като алуминий, хлорен газ, метален натрий и за пречистване или защита на различни метали, както при галваничните или галваничните процеси, които се състоят в покриване на някакъв предмет с метал, като сребро, медно покритие, никелиране, позлатяване и хромация; когато стоманата е покрита с цинк, това се нарича поцинковане.
В раздела на Електрохимия на нашия уебсайт ще намерите повече подробности за всички аспекти, свързани с клетките и батериите, както и електролизата.
От Дженифър Фогаса
Завършва химия
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
FOGAÇA, Дженифър Роча Варгас. „Какво е електрохимия?“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletroquimica.htm. Достъп на 27 юни 2021 г.
Химия

Електролиза, електролитни разтвори, електрически ток, окислително-редукционни реакции, спонтанен химичен процес, химичен процес неспонтанен, трансформатор, изкуствена трансформация, индустрии, алкални метали, алкална земя, водороден газ, газ cl