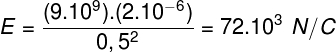Бензин и пара
Разликата между газ и пара се дава от критичната температура. Парите са материя в газообразно състояние, състояние, което може да се втечни с нарастващо налягане. Бензинът не е същото. Това е течност, която не може да се втечни с просто повишаване на налягането. Това прави газа различен от парата.
Поведение на газовете
Дадено вещество в газообразно състояние е газ, ако температурата му е по-висока от критичната температура, ако температурата е равна или по-ниска от критичната температура, веществото е пара.
Истинските газове, които обикновено познаваме, като хелий, азот и кислород, имат различни и специфични молекулярни характеристики на всеки един. Ако обаче ги поставим на високи температури и ниско налягане, те започват да показват много сходно поведение. При изследването на газовете се възприема прост теоретичен модел, който на практика не съществува, с поведение, подобно на това на реалните газове. Това сближаване става по-добро, колкото по-ниско е налягането и толкова по-висока е температурата. Този газов модел се нарича
Около 17 и 19 век трима учени (Жак Шарл, Луис Дж. Гей-Лусак и Пол Е. Clayperon), след изучаване на поведението на газовете, разработва закони, регулиращи поведението на съвършени газове, наричани още идеални газове. Определените от тях закони установяват правилата за „външното“ поведение на перфектния газ, водещ до брои само физическите величини, които са свързани с тях, а именно: обем, температура и натиск.
Общ закон на съвършените газове
Изразът, който определя общия закон за перфектните газове, може да се види, както следва:
Не спирайте сега... Има още след рекламата;)
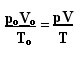
където pО, VО и ТО са първоначалното налягане, първоначалния обем и първоначалната температура, съответно. Това е израз, който се използва, когато променливите на даден газ варират.
Законът на Бойл
Робърт Бойл, физик и химик, беше този, който определи закона, който урежда трансформациите, на които се подлага един газ, когато температурата му се поддържа постоянна. Неговият закон казва, че когато газът претърпи изотермична трансформация, налягането му е обратно пропорционално на заемания обем. От този закон получаваме, че как TО = T Ние трябва да:
PОVО = pV
Законът на Чарлз
Законът на Чарлз е законът, който управлява трансформациите на перфектен газ до постоянен обем. Тези трансформации се наричат изохорни или изометрични трансформации. Според този закон, когато перфектната газова маса претърпи изохорна трансформация, нейното налягане е право пропорционално на абсолютната температура. Математически този закон може да бъде изразен по следния начин:

където pО и ТО са първоначалното налягане и началната температура съответно.
Законът на Гей-Люсак
Законът на Гей-Люсак е законът, който урежда трансформациите на перфектен газ при постоянно налягане. Този закон, въпреки че носи името Гей-Лусак, вече е бил открит от физика и химика А. С. Чарлз. Според закона, когато газът претърпи изобарна трансформация, обемът на газа е право пропорционален на абсолютната му температура. Математически този закон може да бъде изразен по следния начин:

Където VО и ТО съответстват съответно на първоначалния обем и началната температура.
От Марко Аурелио да Силва
Виж повече!!
Газови трансформации
Знаете какво представляват газовите трансформации.
Искате ли да се позовавате на този текст в училище или академична работа? Виж:
SANTOS, Марко Аурелио да Силва. „Изследване на газове“; Бразилско училище. Наличен в: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Достъп на 27 юни 2021 г.