Когато подлагаме различни елементи на действието на пламък, забелязваме, че всеки от тях излъчва различен цвят. Например, ако изгорим стронций, натрий и медна сол, ще видим съответно червените цветове, интензивно жълтото и зеленото, както е показано на следващата фигура:

Ако светлината от тези пламъци попадне върху призма, a прекъснат спектър, тоест ще се наблюдават само няколко цветни ярки линии, разпръснати в области без светлина. За всеки елемент ще имаме различен спектър.

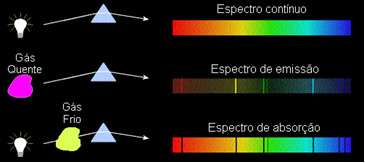
Тези видове спектри се наричат емисионен спектър, тъй като са издадени от определен елемент и служат за неговото идентифициране.
Възможно е да се получат подобни спектри с помощта на светлинен лъч, произведен в електрическа разрядна тръба при висока температури и ниско налягане, съдържащи газове от определени елементи като водород или като благородни газове по-долу:

Чрез преминаване на това електромагнитно излъчване (светлина), произведено през призма, се получават емисионните спектри на всеки от тези елементи.
Преди се смяташе, че постигнатият слънчев спектър е напълно непрекъснат, но английският учен Уилям Хайд Уоластън установи, че от работейки с много тесен лъч светлина, с процеп около 0,01 mm, можете да видите, че слънчевият спектър съдържа седем черни линии за това. По-късно младите
Йосиф Фраунхофер (1787-1826), използвайки призми и дифракционни решетки, установява, че слънчевият спектър всъщност съдържа хиляди насложени черни линии.По-късно физическото Густав Робърт Кирхоф той забеляза, че жълтите петна, постигнати от натриевия спектър, са точно на същото място като две черни линии в спектъра на Слънцето. той и химикът Робърт Вилхелм Бунзен извърши няколко експеримента и забеляза, че ако бяла светлина от горелката на Бунзен, като слънчева светлина, премине от жълтата светлина, излъчвана от натрия, и призмата се пресече, за да генерира спектъра; резултатът ще бъде непрекъснат слънчев спектър, в цветове на дъгата, но с черните линии (наречени D линии от Fraunhofer) в същото положение като жълтите линии в натриевия спектър.
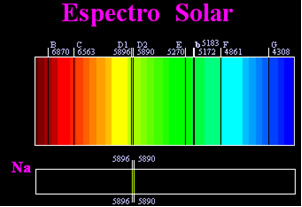
Слънцето излъчва светлина от всички цветове, от червено до виолетово, но когато преминават през земната атмосфера, присъстващите газове поглъщат слънчевата светлина точно в цветовете, които излъчват.
Тези видове спектри се наричат абсорбционни спектри.
Въз основа на тези наблюдения, Кирхоф създаде три закони за спектроскопия, които са:
1) Тяло непрозрачен горещо, във всяко от трите физически състояния, излъчва спектър непрекъснато.
2) Газ прозрачен - като тези на благородните газове, които видяхме по-горе - произвежда а емисионен спектър, с появата на линии ярък. Броят и положението на тези линии ще се определят от химичните елементи, присъстващи в газа.
3) Ако a непрекъснат спектър преминава през газ при най-ниската температура студеният газ причинява наличието на тъмни линии, това е абсорбционен спектър. Това се случи със спектъра на слънчевата светлина, преминаваща през натриевия газ. В този случай броят и разположението на линиите в абсорбционния спектър също зависят от химичните елементи, присъстващи в газа.
От Дженифър Фогаса
Завършва химия
Източник: Бразилско училище - https://brasilescola.uol.com.br/quimica/espectros-emissao-absorcao-leis-kirchhoff.htm
