ال نظرية الثماني اقترحه نيوتن لويس ، الذي لاحظ في الدراسات أن التفاعل الذري يحدث بحيث يكتسب كل عنصر الاستقرار الإلكتروني للغاز النبيل، أي ثمانية إلكترونات في طبقة التكافؤ. ومع ذلك ، في بعض الجزيئات ، يحدث ما يسمى بتوسع أو تقلص الثماني ، أي أن الذرة المركزية تنشئ روابط متوقعة إلى حد ما.
اقرأ أيضا: الرابطة التساهمية - التصنيفات والخصائص
كيف تعمل نظرية الثماني؟
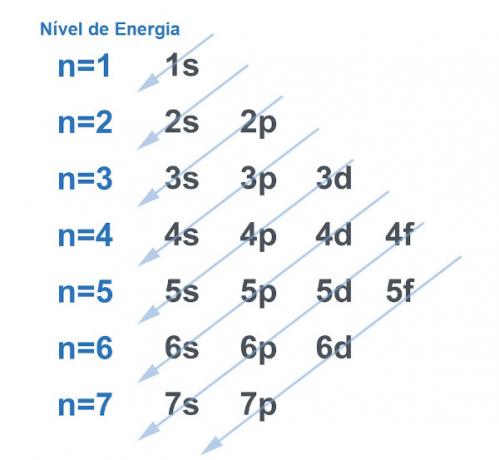
بالطبع تميل جميع الأنظمة إلى البحث عن طريقة الحصول على أكبر قدر ممكن من الاستقرار، وهذا لا يختلف مع الذرة. الذرات هي "جسيمات أساسية" من أي مادة ولكل منها غلاف كهربائي في بنيتها. تم تقسيم هذا الغلاف الكهربائي بواسطة لينوس بولينج في مستويات الطاقة والمستويات الفرعية. طور بولينج رسمًا تخطيطيًا لتوضيح كيف سيبدو توزيع الإلكترونات حول نواة الذرة.
انظر الصورة أدناه:

كل مستوى ومستوى فرعي يحملان مقدارًا من الإلكترونات. عند إجراء تشبيه ، يمكننا القول أن كل مستوى عبارة عن رف ، وكل مستوى فرعي عبارة عن صندوق. في كل مربع ، تناسب اثنين من الإلكترونات. تكون الذرة مستقرة عندما يتم إقران جميع إلكتروناتها ، أي عندما يكون هناك كل الصناديق مع إلكترونين لكل منهما.
مثال:
لنقم بالتوزيع الإلكتروني للأكسجين (O) ، الذي يحتوي على ثمانية إلكترونات في حالته الطبيعية.

لاحظ أنه لدينا في طبقة التكافؤ (الطبقة L ، في المستوى الفرعي p) إلكترونين غير متزاوجين. هذه الإلكترونات هي التي تنشئ روابط كيميائية مع العناصر الأخرى تتطلع إلى تشكيل أزواج إلكترونية.
تستند نظرية الثماني على رياضيات تجميع الإلكترونات. إذا كانت جميع المستويات الفرعية لقذيفة الإلكترون الأخيرة تحتوي على إلكترونين لكل منهما ، فإن غلاف التكافؤ سيكون له ما مجموعه ثمانية إلكترونات ، وبالتالي ، ستكون الذرة مستقرة.
اقرأ أيضا: الأرقام الكمية - الأرقام المرتبطة بكمية طاقة الإلكترون
غازات نبيلة
الغازات النبيلة هي العناصر الوحيدة التي يمكن العثور عليها في الطبيعة في شكل أحادي الذرة، أي بدون إنشاء رابطة مع ذرة أخرى. هذا لأنها تتميز بالاستقرار الإلكتروني. تحتوي جميعها تقريبًا على ثمانية إلكترونات في غلاف التكافؤ.، مع مراعاة قاعدة الثمانيات ، باستثناء غاز الهليوم ، الذي يحتوي على إلكترونين فقط.

استثناءات لنظرية الثمانية
تمكنت بعض المركبات من الاستقرار مع أكثر أو أقل من ثمانية إلكترونات في غلاف التكافؤ. في هذه الحالات ، تحدث استثناءات لنظرية الثمانيات.
توسيع ثماني بتات
يحدث بشكل أساسي مع الفوسفور (P) والكبريت (S) ، وهما ذرات كبيرة نسبيًا ولها المستوى الفرعي "d". في هذه الحالة ، تحتوي الذرة على أكثر من ثمانية إلكترونات في غلافها الأخير.
مثال:

في حالة سادس فلوريد الكبريت ، تم ترك العنصر المركزي مع 12 إلكترونًا، تتجاوز الـ 8 المطلوبة لتحقيق الاستقرار وفقًا لقاعدة الثمانيات. في هذه الحالة ، كان هناك توسع في الثماني.
انكماش ثماني بتات
يحدث مع البريليوم (بي) والبورون (ب) وبعض أكاسيد من النيتروجين. انظر المثال:

في حالة ثلاثي فلوريد البورون ، تكتسب ذرات الفلور الإلكترونات الثمانية الضرورية في غلاف التكافؤ من خلال المشاركة إلكترونية مع البورون ، مع احترام قاعدة الثماني ، لكن الذرة المركزية (البورون) لا تستقر مع ستة إلكترونات ، وبالتالي تحدث واحد تقلص الثماني.
الوصول أيضًا إلى: تصنيف ارتباط سيجما: ما هي المعايير؟
تمارين حلها
السؤال رقم 1 - (Mackenzie-SP) لكي تحصل ذرات الكبريت والبوتاسيوم على تكوين إلكتروني مساوٍ لتكوين الغاز النبيل ، من الضروري أن:
(البيانات: العدد الذري S = 16 ؛ ك = 19.)
أ) يستقبل الكبريت إلكترونين ويستقبل البوتاسيوم 7 إلكترونات.
ب) يعطي الكبريت 6 إلكترونات ويستقبل البوتاسيوم 7 إلكترونات.
ج) الكبريت ينتج 2 إلكترون والبوتاسيوم ينتج 1 إلكترون.
د) الكبريت يستقبل 6 إلكترونات والبوتاسيوم يعطي 1 إلكترون.
هـ) الكبريت يستقبل إلكترونين والبوتاسيوم يعطي إلكتروناً واحداً.
القرار
البديل E. الكبريت هو عنصر من عناصر العمود 16 أو الأسرة 6 أ. تميل عناصر هذه العائلة إلى تلقي إلكترونين لتكوين أزواج إلكترونية ولديها إجمالي ثمانية إلكترونات في غلاف التكافؤ. تحتوي عناصر عائلة 1A ، وهي الفلزات القلوية ، على إلكترون واحد فقط في غلاف التكافؤ. من خلال التبرع بهذا الإلكترون ، تصبح الطبقة السابقة طبقة التكافؤ ، التي تحتوي بالفعل على الإلكترونات الثمانية ، وفقًا لما تمليه قاعدة الثمانية.
السؤال 2 - الحكم على العبارات التالية على أنها صواب (T) أو خطأ (F).
() تنص قاعدة الثمانيات على أن هناك حاجة لثمانية إلكترونات في غلاف التكافؤ حتى تكون الذرة مستقرة.
II () طبقة التكافؤ هي الطبقة الإلكترونية الثانية للذرة.
يميل الكلور (Cl) ، من عائلة الهالوجين ، إلى اكتساب إلكترونين لاكتساب الاستقرار.
IV () الصوديوم (Na) ، عنصر من عائلة 1A ، يميل إلى فقد الإلكترون الوحيد في غلاف التكافؤ.
ضع علامة على البديل الصحيح:
أ) الأول والثالث والرابع صحيح.
ب) الأول والرابع صحيحان.
ج) أنا فقط هو الصحيح.
د) فقط الرابع خاطئ.
هـ) كلها صحيحة.
القرار
البديل ب. أنا والرابع صحيحان. العبارة II غير صحيحة ، لأن طبقة التكافؤ هي الطبقة الإلكترونية الأخيرة من الذرة وليست الثانية. والبيان الثالث يقول أن الكلور يميل إلى اكتساب إلكترونين ، وهذا لا يتحقق ، لأن الكلور يأتي من تميل عائلة 7A أو 17 إلى اكتساب إلكترون واحد فقط للحصول على التكوين الإلكتروني للغاز النبيل.
بقلم Laysa Bernardes Marques de Araújo
مدرس كيمياء