في تفاعلات الأكسدة مع الكحوليات الثانوية هي تلك التي يكون فيها التفاعل بين مركب عضوي من مجموعة كحول، والتي يجب أن تكون ثانوية ، وما يسمى كاشف باير (KMnO4) في وسط حمضي.
عندما يكون كاشف باير في وسط حمضي (aq / H+) ، فإنه يخضع لتفاعل تحلل ، ينتج عنه أكسيد البوتاسيوم وأكسيد المنغنيز الثاني والأكسجين الناشئ ، كما نرى في المعادلة التالية:
2 كم نو4 (aq / H +) → 2 MnO + K.2س + 5 [س]
في أي تفاعل أكسدة ، فإن الأكسجين الناشئ، التي نشأت من تحلل برمنجنات البوتاسيوم في وسط حمضي ، مهاجمة سلاسل الكربون التي لها روابط pi بين الكربون (الألكينات والألكينات والألكاديين) أو المغلقة (الأعاصير ، الحلزونات العطرية) ، مما يؤدي إلى توليد مركبات كيميائية جديدة.
في حالة تفاعل الأكسدة في الكحوليات الثانوية، قبل فهم آلية التفاعل ، من الضروري تذكر مفهوم الكحول الثانوي. يسمى كحول ثانوي واحد يرتبط فيه الهيدروكسيل (OH) بـ a كربون ثانوي (الكربون مرتبط مباشرة بذرتين كربون أخريين). شاهد تمثيل الكحول الثانوي:
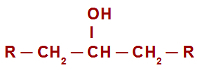
الصيغة التركيبية العامة للكحول الثانوي
في كل تفاعل أكسدة في الكحول ، تهاجم الأكسجين الناشئ الهيدروجين الموجود على الكربون الذي يحتوي على مجموعة الهيدروكسيل.
في حالة تفاعلات الأكسدة في الكحوليات الثانوية ، تحتوي الأكسجين على ذرة هيدروجين واحدة فقط لمهاجمتها في كل بنية من هذا النوع من الكحول.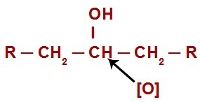
الأكسجين الناشئ يهاجم كحولًا ثانويًا
عند مهاجمة الهيدروجين (H) الموجود في كربون الهيدروكسيل (OH) ، يشكل الأكسجين الناشئ ([O]) هيدروكسيلًا جديدًا على نفس الكربون. لذلك لدينا ديول جيمينو في السجن. نظرًا لأن gemino diol (HO - C - OH) غير مستقر ، فإنه يتحلل إلى جزيء ماء.ومع ذلك ، بين الكربون والأكسجين المتبقي من أحد الهيدروكسيل ، هناك تكوين رابطة مزدوجة (باي وسيغما).
لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
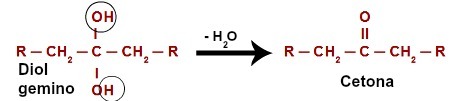
معادلة كيميائية لأكسدة كحول ثانوي
المنتج الذي نشأ من تفاعل أكسدة للكحوليات الثانوية هو دائمًا أ كيتون, لأن الرابطة المزدوجة تتولد دائمًا عند الكربون الثانوي ، مما ينتج عنه كربونيل بين كربونين ، وبالتالي تكوين كيتون.
انظر الآن أ مثال على تفاعل الأكسدة في الكحوليات الثانوية.
مثال: بيوتان 2 - رأ
ا البيوتان -2- ol هو كحول ثانوي، لأن الهيدروكسيل متصل بذرة كربون ثانوية. إذن ، على الكربون الذي يحتوي على الهيدروكسيل ، يوجد هيدروجين واحد فقط. يمكننا التحقق من هذه الحقيقة في الهيكل أدناه:

عندما تتعرض لوسط يحتوي على ماء وحمض و KMnO4 (كاشف باير) ، و هيدروجينك يهاجمه أكسجين ناشئ، يتحول إلى هيدروكسيل جديد ، مما ينتج عنه ديول الجيمينو.

أخيرًا ، هناك تحلل لهذين الهيدروكسيل الموجودين في gemino diol ، ينتج عن ذلك جزيء ماء وكيتون ، بسبب الحاجة إلى إنشاء رابطة بين الكربون وأحد الأكسجين في الهيدروكسيل المتحلل.

يمكننا تمثيلها تفاعل أكسدة البيوتان -2-أول بالكامل بالمعادلة التالية:

بي ديوغو لوبيز دياس
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ بحث:
DAYS ، ديوغو لوبيز. "تفاعلات الأكسدة في الكحوليات الثانوية" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/reacoes-oxidacao-alcoois-secundarios.htm. تم الوصول إليه في 27 يوليو 2021.
كيمياء

مجموعة الهيدروكسيل الوظيفية ، الكحولات الأولية ، الكحولات الثانوية ، الكحولات الثلاثية ، الميثانول ، الجلسرين ، الإيثانول ، تحضير النتروجليسرين ، صناعة الطلاء ، إنتاج المشروبات الكحولية ، حمض الأسيتيك ، الوقود السيارات.

