ا التيتانيوم هو العنصر الكيميائي برمز Ti والعدد الذري ، أي عدد البروتونات يساوي 22. يقع هذا المعدن في المجموعة 4 و 4 من الجدول الدوري.
الكتلة الذرية للعنصر هي 47.867 ش ، ولأنه يحتوي على 22 إلكترونًا في إلكترونات الذرة ، فإن توزيعه الإلكتروني هو 1 ثانية2 2 ثانية2 2 ص6 3 ثانية2 3 ص6 4 ثانية2 ثلاثي الأبعاد2.
التيتانيوم له خصائص مرغوبة للعديد من التطبيقات حيث أنه قوي مثل الفولاذ وأخف وزناً.
لأنه معدن مطيل ، حراري ، مقاوم للتآكل ، فإنه يقدم مقاومة ميكانيكية ، الاستقرار الحراري وانخفاض التفاعل ، يضاف إلى السبائك المعدنية بحيث يكون لها ارتفاع أداء. كما أن توافقها الحيوي وعدم تسممها يجعلها مفيدة أيضًا في صنع الأطراف الاصطناعية للعظام.
الخصائص الرئيسية للتيتانيوم هي:
- نقطة الانصهار: 1668 درجة مئوية
- نقطة الغليان: 3287 درجة مئوية
- الكثافة: 4.5 جم / سم3
- اللون: الرمادي الفضي
- الحالة الفيزيائية عند 20 درجة مئوية: صلبة
- النظائر: Ti46، أنت47، أنت48، أنت49 وأنت50
اكتشف الإنجليزي ويليام جريجور هذا العنصر الكيميائي في عام 1791 واسمه مشتق من اليونانية جبابرة، في وقت لاحق نسبه مارتن هاينريش كلابروث.
التيتانيوم هو العنصر التاسع الأكثر وفرة على هذا الكوكب ويوجد في قشرة الأرض في الخامات مثل الروتيل (TiO)
2) والإلمنيت (FeTiO3). لذلك ، فإن التعدين هو الطريقة الرئيسية للحصول على هذا المعدن.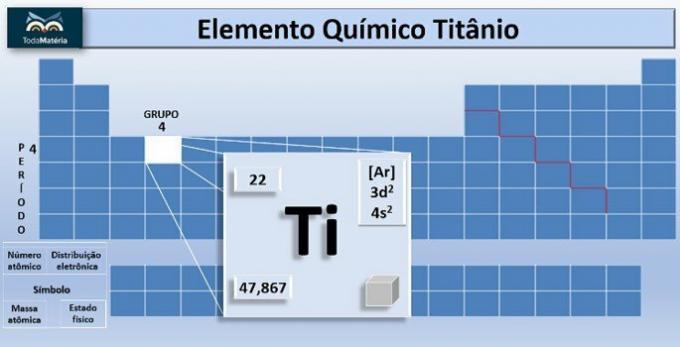
ما هو التيتانيوم المستخدم؟
نظرًا لأنه غير متفاعل كيميائيًا في درجة حرارة الغرفة ، يسهل تشكيله ، وله مقاومة ميكانيكية عالية ومقاومة للتآكل ، يتم استخدام التيتانيوم كمعدن استراتيجي.
تعد صناعات الطيران والفضاء هي المستخدمين الرئيسيين للتيتانيوم لإنتاج الأجزاء ، مثل مكونات التوربينات وجسم الطائرة. ومن التطبيقات الأخرى تصنيع تركيبات الأسنان ، وزراعة الأسنان ، والمجوهرات.
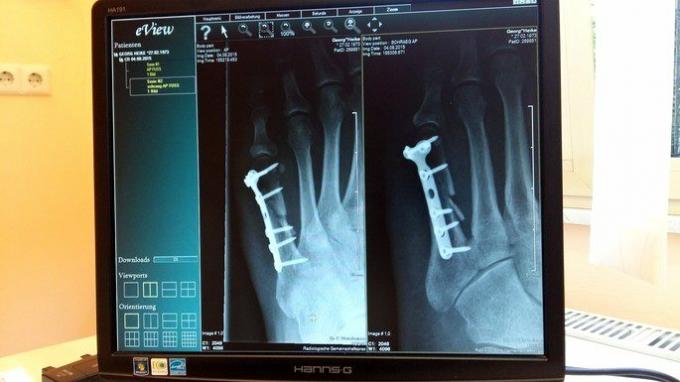
في الطب ، يعتبر التيتانيوم مفيدًا جدًا بسبب توافقه مع الأنسجة البشرية وخفته وقوته. يتم استخدامه لإنتاج غرسات لأجزاء الجسم ، مثل براغي التثبيت ، واستبدال مفصل الركبة ، وعظم العضد ، وأطراف مفصل الورك ، وغيرها.
ثاني أكسيد التيتانيوم (TiO2) أحد المركبات الرئيسية لهذا العنصر ، حيث يتم استخدامه كعامل تبيض. بشكل عام ، تستخدم الأحبار البيضاء عالية الجودة لتحسين المظهر المرئي للون واللمعان. المنتجات الأخرى ، مثل معاجين الأسنان وواقيات الشمس ، تستخدم أيضًا الصبغة. يوجد أيضًا تطبيق كملون طعام مضاف في منتجات الألبان والحلويات والمشروبات.
في الهندسة المعمارية ، يمكننا أن نرى استخدام التيتانيوم لتغطية الهياكل المنحنية في متحف غوغنهايم في بلباو ، شمال إسبانيا.

في الحياة اليومية ، يمكننا أن نجد العديد من المنتجات التي تحتوي على التيتانيوم في تركيبتها ، مثل إطارات الدراجات والنظارات ومضارب التنس.
في الصناعة الكيميائية ، يستخدم التيتانيوم كمحفز للتفاعلات. بهذه الطريقة ، فإنه يجعل من الممكن التحكم في سرعة التفاعل وتقليل وقت تكوين المنتج دون التأثير على تكوين المواد.
لقد درست صناعة السيارات دمج التيتانيوم في صناعة السيارات لتقليل كتلتها ، وبالتالي تقليل استهلاك الوقود وزيادة تسارعها.
اكتساب المزيد من المعرفة بالمحتويات:
- العناصر الكيميائية
- الجدول الدوري
- ما هي المعادن؟
مراجع ببليوغرافية
ATKINS ، PW ؛ جونز ، ل. مبادئ الكيمياء: التشكيك في الحياة الحديثة والبيئة. 3. ed. بورتو أليغري: بوكمان ، 2006.
فيلتري ، ر. أساسيات الكيمياء: المجلد. غير مرتبطة. الطبعة الرابعة. ساو باولو: موديرنا ، 2005.
لي ، ج. د. كيمياء غير عضوية ليست موجزة جدا. ترجمة الطبعة الخامسة. إنجليزي. الناشر Edgard Blucher Ltd. 1999.