يمكن تمثيل المركبات العضوية بعدة طرق ، مثل الصيغة الهيكلية المسطحة ، أو الصيغة الهيكلية المبسطة أو المكثفة ، أو صيغة الشرطة. ومع ذلك ، فإن أبسط تمثيل يكون عبر الصيغة الجزيئية.

وبالتالي ، دعونا نرى كيفية تحديد الصيغة الجزيئية للمركبات العضوية ، بناءً على الصيغ الأخرى المذكورة أعلاه.
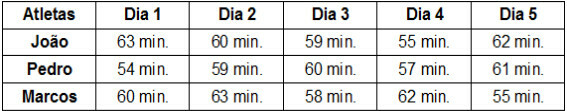
1. من خلال الصيغة الهيكلية المسطحة:توضح هذه الصيغة ترتيب أو ترتيب الذرات داخل الجزيء. على سبيل المثال ، فيما يلي الصيغة الهيكلية المسطحة لأحد الهيدروكربونات الموجودة في البنزين.

لاحظ أنه في هذه الصيغة ، يتم عرض جميع الذرات وجميع الروابط الموجودة بينها. حاليا، لتحديد الصيغة الجزيئية لهذا المركب ، ما عليك سوى حساب عدد ذرات كل عنصر ووضع مؤشر على الجانب الأيمن السفلي من العنصر المعني.
جانب مهم يجب تسليط الضوء عليه هو ذلك نبدأ دائمًا الصيغة الجزيئية للمركبات العضوية من عنصر الكربون، لأنه المكون الرئيسي لهذه المواد. انظر المثال:
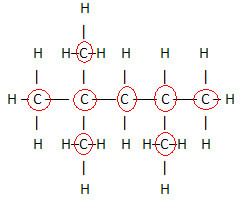
نظرًا لوجود 8 ذرات كربون ، نبدأ في كتابة الصيغة الجزيئية على النحو التالي: ج8
لإكمال هذه الصيغة ، نحسب كمية الهيدروجين:
لذلك ، الخاص بك الصيغة الجزيئية é ج8ح18.
2. من خلال الصيغة الهيكلية المبسطة أو المكثفة:
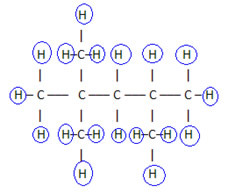
في هذا النوع من الصيغة ، يتم اختصار كمية الهيدروجين. على سبيل المثال ، انظر إلى نفس الصيغة للجزيء الموجود في البنزين ، الآن في صورة مكثفة: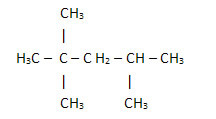
بهذه الطريقة يكون حساب كمية الهيدروجين أسهل ، فقط أضف المؤشرات (3 +3+ 3 +2 +1 +3 +3 = 18).
لكن دعونا الآن نلقي نظرة على الصيغة الهيكلية المكثفة لحمض اللينوليك ، الموجودة في الخضروات مثل القطن وفول الصويا وعباد الشمس ، إلخ. والتي تستخدم في الدهانات والورنيشات:
ح3كوتش2CH2CH2CH2تشوشوتش2تشوشوتش2CH2CH2CH2CH2CH2CH2─ COOH
بحساب كمية الكربون والهيدروجين والأكسجين ، لدينا ما يلي الصيغة الجزيئية من حمض اللينوليك: ج18ح32ا2.
3. من خلال صيغة السكتة الدماغية: تبسط هذه الصيغة أيضًا كيفية تمثيل المركبات العضوية ، حيث إنها تحذف المجموعات C و CH و CH2 و CH3.
مثال على ذلك جزيء اللينوليك ، انظر كيف يبدو:

دعونا نحسب كمية الكربون أولاً ، مع تذكر أنه في هذه الصيغة ، يتم تمثيل كل رابطة بين الكربون بشرطة. وهكذا ، فإن النصائح ونقطتي الانقلاب تتوافق مع ذرات الكربون.
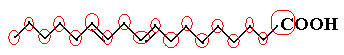
اذا لدينا: ج18
الآن ، لحساب كمية الهيدروجين ، علينا أن نتذكر أن الروابط بين ذرات الكربون والهيدروجين ضمنية ، حيث يُعرف أن الكربون يصنع أربع روابط ؛ وبالتالي ، فإن مقدار الروابط المفقودة هو مقدار الهيدروجين المرتبط بهذا العنصر.
انظر التفسيرات أدناه:
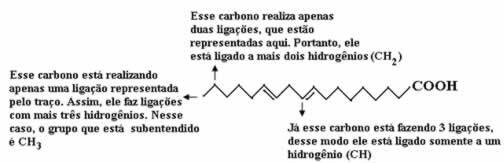
وبالتالي ، ستكون كمية الهيدروجين: 32.

من السهل حساب كمية الأكسجين ، حيث لا يوجد سوى اثنين. منذ الصيغة الجزيئية é: ج18ح32ا2.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm