ال معكرونةالذري، كما يوحي اسمها ، هي كتلة الذرة ، وعادة ما يرمز لها بـ "مال"أو" MA ". ومع ذلك ، نظرًا لأن الذرة عبارة عن كيان صغير للغاية ، غير مرئي للعين البشرية ، فلا يمكن قياس كتلتها باستخدام المقاييس ، على سبيل المثال. لذلك حدد العلماء كتلة الذرات بمقارنتها مع كتل الذرات الأخرى.
يتم ذلك مع الوحدات الأخرى أيضًا. على سبيل المثال ، وحدة الكتلة هي الكيلوجرام القياسي ، الذي يتوافق مع أسطوانة يبلغ ارتفاعها وقطرها 3.917 سم ، مصنوعة من 10٪ إيريديوم و 90٪ بلاتين. لذلك فهي بمثابة مقارنة. على سبيل المثال ، إذا "وزنا" جسمًا على مقياس ووجدنا أن كتلته 10 كجم ، فهذا يعني أن كتلته أكبر 10 مرات من المعيار المختار: 1 كجم.
الأمر نفسه ينطبق على الذرات. كان المعيار المختار هو الكربون -12 ، وتم تحديد كتلة هذه الذرة بشكل تعسفي بمقدار 12 ش. "u" هو وحدة الكتلة الذرية ، وبالتالي يعادل 1/12 من كتلة ذرة الكربون.
على سبيل المثال ، عندما نقول أن الكتلة الذرية للهيدروجين تساوي 1 u ، فهذا يعني أنها كما لو إذا قسمنا الكربون إلى 12 جزءًا ، فإن كتلة أحد هذه الأجزاء تعادل كتلة ذرة هيدروجين. مثال آخر هو الكبريت ، كتلته الذرية 32 u ، مما يعني أن كتلته أكبر 32 مرة من 1/12 من كتلة 12ج.
1 ش = 1/12 من كتلة ذرة كربون واحدة 12

وحدة الكتلة الذرية تساوي 1/12 من كتلة الكربون -12
الكتلة الجزيئية للمواد هي مجموع الكتل الذرية للعناصر. على سبيل المثال ، الكتلة الذرية للأكسجين تساوي 16 ش ، وبالتالي فإن الكتلة الجزيئية لجزيء غاز الأكسجين (O2) يساوي 32 ش.
نظرًا لأن التقنيات المختبرية متقدمة جدًا حاليًا ، فهناك أجهزة تقيس بدقة الكتلة الذرية للعناصر ، مثل مطياف الكتلة. وبالتالي ، من الممكن معرفة ذلك 1 ش يساوي 1.66054. 10-24 ز.
خريطة ذهنية: الكتلة الذرية

* لتنزيل الخريطة الذهنية بصيغة PDF ، انقر هنا!
نظرًا لأنه يتم تحديد الكتل الذرية بدقة كبيرة ، يتم تقديمها في الجدول الدوري في شكل أعداد عشرية. ولكن عندما نذهب لإجراء العمليات الحسابية ، فإننا عادةً ما نستخدم الرقم المقرَّب ، باستثناء التجارب التي يجب أن تكون دقيقة للغاية. على سبيل المثال ، إذا نظرت إلى الجدول الدوري ، فسترى أن الكتلة الذرية للأكسجين تساوي 15999 ش ، لكننا نستخدم بشكل عام القيمة 16 ش في الحسابات. يحدث هذا أيضًا مع الكربون ، الذي تعطى كتلته الذرية بمقدار 12.01 ش ، كما هو موضح أدناه:
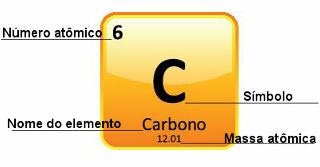
تمثيل الكربون في الجدول الدوري
العناصر التي تظهر في الجدول الدوري هي في الواقع المتوسط المرجح لجميع النظائر الطبيعية للعنصر. وبالتالي ، فإن الكتلة الذرية التي تظهر في الجدول هي أيضًا متوسط الكتل الذرية لهذه العناصر. على سبيل المثال ، يحتوي الكلور (C؟) على نظيرين طبيعيين ، 35 و 37 ، وتبلغ نسبتهما في الطبيعة 75.76٪ و 24.24٪. الكتل الذرية لكل من هذه النظائر مختلفة ، حيث أن C؟ -35 تساوي 34.96885 u وكتلة C؟ -37 تساوي 36.96590.
بهذه الطريقة ، تُحسب الكتلة الذرية للعنصر مع الأخذ في الاعتبار كتلة كل نظير والوفرة التي يظهر بها في الطبيعة. في حالة الكلور لدينا:
الكتلة الذرية لعنصر الكلور = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
الكتلة الذرية لعنصر الكلور = 35.45
هذه هي قيمة الكتلة الذرية للكلور التي تظهر في الجدول الدوري.
* خريطة ذهنية لي ديوغو لوبيز
بقلم جينيفر فوغاسا
تخرج في الآداب
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm


