تدرس الحركية الكيميائية سرعة التفاعلات الكيميائية والعوامل التي تؤثر على معدل تلك التفاعلات.
استخدم الأسئلة أدناه لاختبار معلوماتك والتحقق من التعليقات على القرارات.
السؤال رقم 1
فيما يتعلق بالعوامل التي تؤثر على سرعة التفاعل الكيميائي ، فمن غير الصحيح القول:
أ) كلما زاد تركيز المواد المتفاعلة ، زادت سرعة التفاعل.
ب) كلما زاد سطح التلامس ، زادت سرعة التفاعل.
ج) كلما زاد الضغط ، زادت سرعة التفاعل.
د) كلما ارتفعت درجة الحرارة ، زادت سرعة التفاعل.
هـ) وجود عامل حفاز يحافظ على ثبات معدل التفاعل.
بديل غير صحيح: هـ) وجود عامل حفاز يحافظ على ثبات معدل التفاعل.
تعمل المحفزات على زيادة سرعة التفاعل ، حيث إنها تسهل تكوين المركب المنشط بين المواد المتفاعلة.
مع هذا ، تخلق المحفزات آلية أقصر لتطور التفاعل ، مما يؤدي إلى زيادة السرعة.
السؤال 2
وفقًا لـ _____________ يجب أن تحدث تصادمات فعالة بين الكواشف لتشكيل المنتجات. بالإضافة إلى ذلك ، هناك ما يكفي من ___________ لكسر الروابط الكيميائية للمواد المتفاعلة وتشكيل ___________ ، وهي حالة وسيطة قبل تكوين المنتجات.
الكلمات التي تملأ الفراغات بشكل صحيح هي ، على التوالي:
أ) المحتوى الحراري والطاقة الحركية وتغير المحفز.
ب) نظرية الاصطدام وطاقة التنشيط والمركب المنشط.
ج) سرعة التفاعل ، المحتوى الحراري والمانع.
د) الضغط الجزئي والانتروبيا والركيزة.
البديل الصحيح: ب) نظرية الاصطدام وطاقة التنشيط والمركب المنشط.
وفقًا لنظرية الاصطدام ، فإن التصادمات بين المواد المتفاعلة ضرورية لحدوث تفاعل كيميائي. لهذا ، يجب أن تكون المواد في وضع ملائم حتى تكون الصدمات فعالة.
تعمل طاقة التنشيط كحاجز للطاقة يجب التغلب عليه لكسر روابط المركبات المتفاعلة. كلما انخفضت طاقة التنشيط ، زادت سرعة التفاعل.
المركب المنشط هو نوع وسيط غير مستقر يتكون قبل المنتجات.
السؤال 3
يتم إجراء العبارات الأربعة التالية حول المحفزات:
أنا. يعمل المحفز عن طريق زيادة سرعة التفاعل ، لكنه لا يغير من أدائه.
II. في تفاعل كيميائي لا يتم استهلاك المحفز في مسار التفاعل.
ثالثا. تخلق المحفزات طريقًا بديلًا لتحويل المواد المتفاعلة إلى منتجات. لهذا ، هناك حاجة إلى طاقة تنشيط أكبر.
رابعا. المحفز قادر فقط على تسريع التفاعل في الاتجاه الأمامي.
الخيارات التي تقدم معلومات صحيحة عن المحفزات هي:
أ) الأول والثاني
ب) الثاني والثالث
ج) الأول والرابع
د) الكل
البديل الصحيح: أ) الأول والثاني.
تستخدم المحفزات لتسريع التفاعلات الكيميائية. لا يغير التفاعل باستخدام المحفز إنتاجه ، أي يتم إنتاج الكمية المتوقعة من المنتج ، ولكن في وقت أقل.
لا يتم استهلاك المحفزات أثناء التفاعل الكيميائي ، فهي تساعد في تكوين المركب النشط. لذلك ، يمكن استرجاع المحفز في نهاية التفاعل الكيميائي.
المحفزات قادرة على تقليل وقت التفاعل من خلال إنشاء آلية بديلة لتشكيل المنتجات ذات طاقة التنشيط المنخفضة. لذلك ، يحدث التفاعل بشكل أسرع.
تعمل المحفزات في الاتجاه الأمامي والعكسي للتفاعل.
السؤال 4
تعتمد سرعة حدوث التفاعل الكيميائي على:
أنا. عدد الاصطدامات الفعالة بين الكواشف.
II. ما يكفي من الطاقة لإعادة ترتيب الذرات.
ثالثا. التوجه المناسب للجزيئات.
رابعا. تشكيل مركب نشط.
أ) الأول والثاني
ب) الثاني والرابع
ج) الأول والثاني والثالث
د) الأول والثاني والثالث والرابع
البديل الصحيح: د) الأول والثاني والثالث والرابع.
تحدث الاصطدامات الفعالة عندما تكون المواد المتفاعلة في أوضاع مواتية للصدمات ، مما سيعزز إعادة ترتيب الذرات.
يجب أن تكون طاقة التنشيط كافية حتى يؤدي الاصطدام بين المواد المتفاعلة إلى كسر الروابط وتشكيل المركب النشط.
لا تتسبب جميع الاصطدامات بين الجسيمات المتفاعلة في حدوث التفاعل. الاتجاه الذي يحدث به الاصطدام مهم لتكوين المنتجات لحدوثها.
المركب المنشط هو حالة وسيطة وغير مستقرة قبل تكوين المنتجات. يتم إنشاؤه عندما يتم تجاوز طاقة التنشيط للتفاعل.
السؤال 5
ثاني أكسيد الكربون هو غاز يتكون من التفاعل بين غازات أول أكسيد الكربون وغازات الأكسجين ، وفقًا للمعادلة الكيميائية أدناه.
كو(ز) + ½ ملف2 (ز) → كو2 (ز)
مع العلم أنه في 5 دقائق من التفاعل تم استهلاك 2.5 مول من ثاني أكسيد الكربون ، ما هو معدل تطور التفاعل وفقًا لاستهلاك O2?
أ) 0.2 مول. دقيقة-1
ب) 1.5 مول. دقيقة-1
ج) 2.0 مول. دقيقة-1
د) 0.25 مول. دقيقة-1
البديل الصحيح: د) 0.25 مول. دقيقة-1
للإجابة على هذا السؤال ، يجب أن ننظر إلى المعادلة الكيميائية.
كو(ز) + ½ ملف2 (ز) → كو2 (ز)
لاحظ أن مولًا واحدًا من أول أكسيد الكربون يتفاعل مع نصف مول من الأكسجين لتكوين مول واحد من ثاني أكسيد الكربون.
تشير الكمية الواردة في البيان إلى أول أكسيد الكربون ، ولكن يجب أن تكون الإجابة من حيث الأكسجين. لهذا يجب علينا تنفيذ قاعدة العدد ثلاثة وإيجاد كمية الأكسجين.
1 مول CO - - مول O2
2.5 مول CO - x of O2
س = 1.25 مول
نطبق الآن القيم الموجودة في الصيغة لمعدل تطور التفاعل.
لذلك ، فإن معدل تطور التفاعل فيما يتعلق بالأكسجين هو 0.25 مول. دقيقة-1.
السؤال 6
لاحظ التمثيل الرسومي لتطور تفاعل كيميائي افتراضي ، والذي يربط الطاقة ومسار التفاعل.
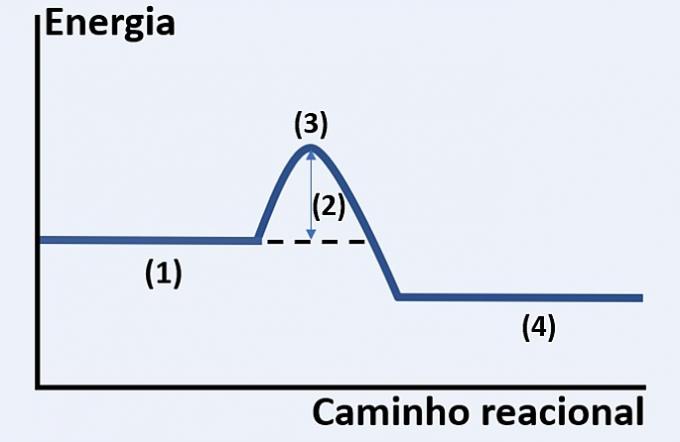
تحقق من البديل الذي يحل محل (1) و (2) و (3) و (4) بشكل صحيح على التوالي.
أ) الركائز ، الحرارة المنبعثة ، حالة الطاقة القصوى ونهاية التفاعل.
ب) الكواشف وطاقة التنشيط والمركب المنشط والمنتجات.
ج) المواد المتفاعلة والطاقة الحركية والمحفز والركائز.
د) المواد المتفاعلة والحرارة الممتصة والطاقة الحرارية والمنتجات.
البديل الصحيح: ب) الكواشف وطاقة التنشيط والمركب المنشط والمنتجات.
الرسم البياني الموضح عبارة عن تفاعل ماص للحرارة ، أي أن هناك امتصاصًا للطاقة لحدوث التفاعل.
أنت الكواشف (1) في بداية الرسم البياني و طاقة التفعيل (2) يتوافق مع الفرق بين الطاقة المخزنة في المواد المتفاعلة وفي تنشيط معقدة (3). أخيرًا ، بعد اجتياز الحالة الوسيطة ، يتم تشكيل منتجات (4).
لذلك ، تحتاج المواد المتفاعلة إلى التغلب على طاقة التنشيط لإعادة ترتيب ذراتها إلى بنية وسيطة تسمى المركب المنشط من أجل تكوين المنتجات.
السؤال 7
المادة أ قادرة على التحلل وتصبح مادة ب. لاحظ تطور رد الفعل هذا في الصورة أدناه.

فيما يتعلق بسرعة رد الفعل ، يمكننا القول:
أ) المادة A تتحلل بين 0 و 15 ثانية بمعدل 0.35 مول-1.
ب) المادة A تتحلل بين 15 و 30 ثانية بمعدل 0.02 مول-1.
ج) المادة A تتحلل بين 0 و 15 ثانية بمعدل 0.04 مول-1.
د) المادة A تتحلل بين 15 و 30 ثانية بمعدل 0.03 مول-1.
البديل الصحيح: د) تتحلل المادة A بين 15 و 30 ثانية بمعدل 0.03 مول.
يمكن حساب معدل تحلل المادة أ بالصيغة:
دعنا نحسب سرعة التفاعل بدلالة المادة أ بين الفترات المحددة.
تتراوح بين 0 و 15:
تتراوح بين 15 و 30:
لذلك ، البديل d صحيح ، حيث تتحلل المادة A بين 15 و 30 ثانية بمعدل 0.03 مول.-1.
السؤال 8
ضع في اعتبارك رد الفعل الافتراضي التالي.
aA + bB → cC + dD
لاحظ الاختلاف في تركيز A و C أدناه.
| الوقت (الأوقات) | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| استهلاك أ (مول / لتر) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| تكوين C (مول / لتر) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
بناءً على المعلومات الواردة في السؤال ، ما هو ، على التوالي ، معدل استهلاك A ومعدل تكوين C في الفترة بين 5 و 25 دقيقة؟
أ) 0.3 مول. إل-1.س-1 و 0.1 مول. إل-1.س-1
ب) - 0.1 مول. إل-1.س-1 و 0.3 مول. إل-1.س-1
ج) - 0.25 مول. إل-1.س-1 و 0.1 مول. إل-1.س-1
د) 0.1 مول. إل-1.س-1 و 0.3 مول. إل-1.س-1
البديل الصحيح: ج) - 0.25 مول. إل-1.س-1 و 0.1 مول. إل-1.س-1.
معدل الاستهلاك:
معدل التدريب C:
لذلك ، في التفاعل ، يتم استهلاك A بمعدل 0.25 مول.س -1 ، لذلك تكون قيمته سالبة ، بينما يتكون B بمعدل 0.1 مول. إل-1.س-1.
اقرأ أيضا:
- حركية الكيميائية
- الكيمياء الحرارية
- التوازن الكيميائي
- تفاعلات كيميائية


