
في بعض الأحيان يمكن أن يحدث ل الصيغة الدنيا أن تكون نفس الصيغة الجزيئية للمركب ؛ مع ذلك، هذا ليس دائما صحيحا.
على سبيل المثال ، الصيغة التجريبية أو الصغرى للمياه هي H2O ، مما يدل على أن هناك نسبة 2: 1 بين العناصر التي تشكل جزيئات الماء. وبالمصادفة ، هذه أيضًا الصيغة الجزيئية للماء. ومع ذلك ، لترى أن هذا لا يحدث دائمًا ، انظر إلى المثالين التاليين:
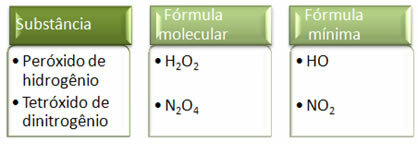
نظرًا لأن الصيغة الدنيا هي فقط نسبة ذرات كل عنصر وليس الكمية الفعلية منها في الصيغة الجزيئية ، فيمكن أن تحدث لمركبات مختلفة لها نفس الصيغة التجريبية وحتى الصيغة الدنيا للمركب يمكن أن تكون نفس الصيغة الجزيئية لـ آخر. لاحظ ، في المثال أدناه ، كيف يمكن أن يحدث هذا:
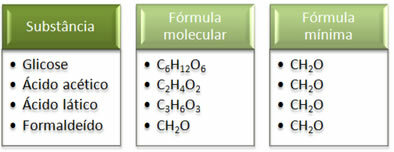
نرى أن الحد الأدنى للصيغة CH2هذا هو نفسه بالنسبة لجميع المواد ، أي أن هذه الصيغة البسيطة تعبر عن أنه ، في جميع الحالات ، توجد ذرات الكربون والهيدروجين والأكسجين في الصيغ الجزيئية بنسبة 1:2:1. علاوة على ذلك ، فإن الصيغة الجزيئية الوحيدة التي لها نفس الصيغة الجزيئية مثل الصيغة التجريبية هي الفورمالديهايد.
- حساب الصيغة الدنيا أو التجريبية:
لتحديد الصيغة التجريبية للمركب ، من الضروري أولاً معرفة النسبة المئوية أو الصيغة التقريبية. يمكن القيام بذلك عن طريق قياس كتلة كل عنصر في 100 جرام من العينة. النص "
صيغة النسبة المئوية أو المئوية”يوضح هذا الأمر بشكل أفضل.لا تتوقف الان... هناك المزيد بعد الإعلان ؛)
على سبيل المثال ، لنفترض أن التركيب التقريبي لمركب معين معطى بواسطة: 40.00٪ C و 6.67٪ H و 53.33٪ O. نقوم بتمرير هذه القيم إلى الجرامات ، مع الأخذ في الاعتبار كتلة 100 جرام من عينة السماد. وهكذا ، لدينا: 40 جم من C و 6.67 جم من H و 53.33 جم من O.
الآن من الضروري تمرير هذه القيم إلى كمية المادة (مول). نقوم بذلك عن طريق قسمة كل من القيم الموجودة بواسطة كتلها المولية الخاصة بكل منها:
ج: 40/12 = 3.33
ح: 6.67 / 1 = 6.67
O: 53.33 / 16 = 3.33
نظرًا لأن القيم ليست أعدادًا صحيحة ، فنحن نستخدم الجهاز التالي: نقسم جميع القيم على أصغرها حتى لا تتغير النسبة بينها.
في هذه الحالة أصغر قيمة هي 3.33 ، وبالتالي ستكون النتيجة:
ج: 3.33 / 3.33 = 1
ح: 6.67 / 3.33 = 2
O: 3.33 / 3.33 = 1
وبالتالي ، فإن الصيغة الدنيا لهذه المادة غير المعروفة تساوي: ج1ح2ا1 أو CH2ا.
باختصار ، الخطوات اللازمة لإيجاد الصيغة التجريبية أو الصغرى لمادة ما هي:

بقلم جينيفر فوغاسا
تخرج في الكيمياء
هل ترغب في الإشارة إلى هذا النص في مدرسة أو عمل أكاديمي؟ نظرة:
فوغا ، جينيفر روشا فارغاس. "الصيغة الدنيا أو التجريبية" ؛ مدرسة البرازيل. متوفر في: https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm. تم الوصول إليه في 28 يونيو 2021.


