يحدث تفاعل معادل عندما يتفاعل حمض مع قاعدة لتكوين الماء والملح. يوفر الحمض أيونات H+ وتوفر القاعدة أيونات OH- لتكوين الماء (H2س):
1 ساعة+(هنا) + 1 أوه-(هنا) → H.2ا(ℓ)
يسمى هذا النوع من التفاعل "التعادل" لأنه يتم تحييد الأس الهيدروجيني للوسط ؛ الرقم الهيدروجيني للماء 7.0 (محايد).
لكي تحدث هذه التفاعلات ، من الضروري إطلاق قدر معين من الحرارة ، كجزء فقط من طاقة تُستخدم الأيونات لتكوين الروابط التي ينتج عنها جزيئات الماء ، بينما يتم إطلاق باقي الطاقة إلى الى حد كبير. تسمى هذه الطاقة الصادرة المحتوى الحراري المعادل (∆Hتحييد).

نظرًا لأنه يطلق الحرارة ، فإنه يتوافق مع التفاعلات الطاردة للحرارة ، حيث يكون المحتوى الحراري (الطاقة العالمية للنظام) سالبًا دائمًا ، أقل من الصفر.
في حالة حدوث تفاعل بين الأحماض القوية والقواعد القوية ، ستكون قيمة المحتوى الحراري المعادل دائمًا مساوية لـ - 13.8 كيلو كالوري / مول أو - 57.7 كيلو جول / مول. يحدث هذا لأن القواعد والأحماض القوية منفصلة تمامًا في المحلول ، وبالتالي فهي الوحيدة سيكون التفاعل المسؤول عن ظهور الحرارة هو تكوين الماء ، كما هو موضح في الأمثلة الثلاثة أدناه:
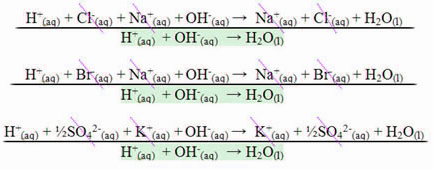
في حالة تفاعلات التعادل التي تشتمل على أحماض أو قواعد ضعيفة ، فإن قيمة المحتوى الحراري المعادل ستكون أقل من -57.7 كيلوجول / مول.
بقلم جينيفر فوغاسا
تخرج في الكيمياء
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/quimica/entalpia-neutralizacao.htm

