يمكن وصف مفاهيم العمليات القابلة للعكس والتي لا رجعة فيها رياضيًا باستخدام مفهوم الانتروبيا. لكن قبل أن نصل إلى تعريف الإنتروبيا ، دعنا نصل إلى مفاهيم العمليات القابلة للعكس والتي لا رجوع فيها. نحن نتصل عملية قابلة للعكس واحد يمكن للنظام أن يعود فيه تلقائيًا إلى الوضع الأصلي (أو الحالة). عملية لا رجوع فيها هو نظام لا يستطيع نظامه العودة تلقائيًا إلى حالته الأصلية.
نظرًا لأن مفاهيم أنواع العمليات قد تم ذكرها بالفعل ، فلننتقل إلى تعريف الإنتروبيا. ال غير قادر علي من نظام (S) هو مقياس لدرجة عدم التنظيم. كلما كانت المنظمة أكبر ، كلما انخفض الانتروبيا. الانتروبيا هي سمة من سمات الحالة الديناميكية الحرارية ، وكذلك الطاقة الداخلية والحجم وعدد الشامات.
بالنظر إلى الحاويات في الشكل أعلاه ، نرى أن الحاوية 1 بها غير قادر علي أصغر من الآخر. إذا أخذنا الحاوية ورجناها ، فسوف نتحقق من أن "الكرات" ستكون مختلطة ، أو بالأحرى غير منظمة. إذا تحققنا من الحاوية 2 ، بعد رجها ، سنلاحظ أنه لا يمكن للكرات ، تلقائيًا ، عد إلى مؤسستهم الأصلية ، إذا واصلنا هز وعاء.
في العمليات المتساوية القابلة للانعكاس (التي تظل درجة حرارتها دائمًا كما هي) ، نحدد الإنتروبيا على أنها نسبة الحرارة (المعطاة أو المستلمة) إلى درجة الحرارة. وبالتالي ، فإننا نمثل الانتروبيا في العمليات المتساوية على النحو التالي:
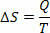
في النظام الدولي للوحدات ، نقيس الإنتروبيا بالجول / كلفن. بناءً على المفهوم الذي نصفه عن الإنتروبيا ، يمكننا صياغة القانون الثاني على النحو التالي:

دائمًا ما يكون تغيير الانتروبيا في النظام المعزول إيجابيًا أو فارغًا. تحدث المساواة ΔS = 0 عندما تكون العمليات قابلة للعكس: العمليات القابلة للعكس لا تزيد الانتروبيا. يمكن للأنظمة المعزولة ، التي لا تستقبل أو تعطي حرارة للبيئة ، أن تزيد إنتروبياها أو تحافظ على ثباتها.
بقلم دوميتيانو ماركيز
تخرج في الفيزياء
فريق مدرسة البرازيل
مصدر: مدرسة البرازيل - https://brasilescola.uol.com.br/fisica/entropia-segunda-lei.htm