У тексті "Магматичний електроліз”, Було пояснено, що цей процес відбувається, коли електричний струм проходить в розплавленій речовині (у рідкому стані), без присутності вода і, таким чином, катіон отримує електрони, а аніон віддає електрони, так що обидва мають електричний заряд, рівний нулю, і енергію накопичений.
Щоб краще зрозуміти, як відбувається магматичний електроліз, давайте розглянемо один з найважливіших прикладів цього типу процесу - електроліз хлориду натрію або кухонної солі (NaCl).
Хлорид натрію утворюється в природі шляхом перенесення електрона з натрію (Na) в хлор (Cl), згідно з реакцією нижче:
2Na (s) + 1Cl2(g) → 2NaCl (s)

Цей процес відбувається спонтанно, але зворотний процес цієї реакції не є спонтанним, тобто утворення газоподібного хлору (Cl2(g) - малюнок нижче), а металевий натрій (Na (s)) у природі не зустрічається. Якщо ми хочемо, щоб це сталося, нам доведеться розпочати процес.
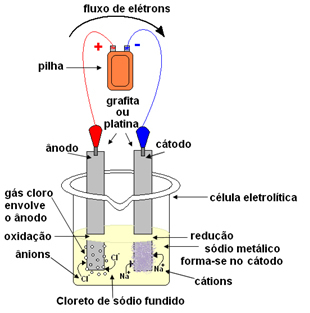
Це можна зробити магматичним електролізом. Сіль нагрівають до температури вище 800,4 ° С, що є її температурою плавлення; і таким чином він зливається, переходячи від твердого до рідкого. У цьому фізичному стані ваші іони Na
+ і Cl- безкоштовні.Потім розплавлену сіль поміщають у контейнер, електролітичний посудину, і два інертні платинові або графітові електроди занурюють у хлорид натрію. Ці електроди підключені до джерела, яке генерує постійний електричний струм, такого як акумулятор або елемент.
З проходженням електричного струму відбувається наступне:
- Негативний полюс батареї або елемента подає електрони до одного з електродів, який стає катодом;
- Катод: приймає електрони з клітини і стає негативним полюсом, залучаючи катіони Na+, оскільки притягуються протилежні заряди. Ці іони отримують електрони від електрода (катода) і відбувається їх відновлення, утворюючи металевий натрій:
Зниження:В+(ℓ) + та- → В(s)
Металевий натрій осідає поверх електрода і направляється у резервуар.
- Анод: стає позитивно зарядженим, залучаючи аніони Cl- (тому його називають анодом). Ці іони втрачають свої електрони при контакті з анодом і, отже, вони піддаються окисленню, утворюючи атоми хлору, які відразу ж поєднують два по два, утворюючи газоподібний хлор:
Окислення:2Cl-(ℓ) → 2 і- + 1Cl2(g)
Цей газ барботує навколо анода і збирається скляною трубкою, пристосованою до системи.
Таким чином, загальна реакція, яка виникає в цьому випадку, визначається:
Катод: 2Na+(ℓ) + 2e- → 2Na(s)
Анод: 2Cl-(ℓ) → 2 і- + 1Cl2(g) ____________
Глобальна реакція: 2Na+(ℓ) + 2Cl-(ℓ) → 2Na(s) + 1Cl2(g)
Іншим важливим аспектом, про який слід пам’ятати, що було виділено в кінці згаданого тексту (Магматичний електроліз), є те, що для електролізу коли комірка або акумулятор, що використовуються для генерації електричного струму, повинні мати ddp (різницю потенціалів), рівну або більшу за різницю потенціалів реакція.
Давайте розглянемо це у випадку електролізу хлориду натрію, який ми розглядаємо. Щоб з'ясувати різницю потенціалів цієї реакції, досить зменшити стандартний потенціал відновлення катода на потенціал анода. Це пояснюється в тексті. Потенційна різниця акумулятора .
Через таблицю стандартних потенціалів відновлення (Е0червоний), ми знаємо, що:
В+(ℓ) + та- → В(s) І0червоний = -2,71
2Cl-(ℓ) → 2 і- + 1Cl2(g) І0червоний = +1,36
Тепер просто зменшіть ці значення, щоб знати різницю потенціалів глобальної реакції:
∆І0 = І0червоний (катод) - І0червоний (анод)
∆І0 = -2,71 – (+ 1,36)
∆І0 = - 4,07 В
Отже, це означає, що для проведення магматичного електролізу хлориду натрію комірка або акумулятор, що буде використовуватися, повинні мати напругу, рівну або більшу за 4,07 В.
Негативне значення лише вказує на те, що це неспонтанний процес.. У випадку батарей, що є спонтанним процесом, значення електрорушійної сили (∆E0) завжди дає позитив.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/eletrolise-Ignea-cloreto-sodio.htm

