О атомний радіус (r) зазвичай визначається як половина відстані між двома ядрами сусідніх атомів, як на малюнку нижче представлено:

атомний радіус
Радіус атома відрізняється від одного атома до іншого відповідно до його сімейства та періоду в Періодичній системі. Щодо елементів, що належать до того ж сімейства, його атомний радіус збільшується зі збільшенням атомного числа., тобто зверху вниз. Бо в цьому сенсі це означає, що від одного атома до іншого енергетичний рівень або електронний шар збільшився, тому його радіус збільшується пропорційно.
Що стосується стихії в той же період, тобто горизонтально, радіус збільшується справа наліво або в міру зменшення атомного числа. Це тому, що всі вони мають однакову кількість шарів, різницею є кількість електронів у цих шарах, і чим більше електронів, тим більше притягання до ядра, зменшуючи таким чином радіус атом.

Напрямок зростання атомного радіуса відповідно до сімейства та періоду в Періодичній системі
Однак атомний радіус може змінюватися в залежності від встановленого з'єднання. Давайте подивимося, як це відбувається:
* Іонний зв’язок: Якщо атом утворює a катіона, атомний радіус зменшиться, оскільки втрачаючи один або кілька електронів, ядро буде інтенсивніше залучати електрони. Тепер якщо утворюють аніон, тобто отримують електрони, радіус атома збільшиться, оскільки загальний заряд електросфери буде більше загального заряду ядра, зменшуючи його притягання. Чим більше електронів ви отримаєте або втратите, тим більшими будуть зміни в розмірі променя.
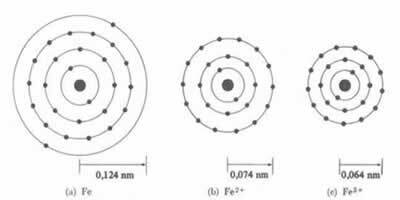
Діаметр або радіус катіона завжди менший за діаметр або радіус атома
Крім того, в серії ізоелектронні іони, які мають однакову кількість електронів та енергетичних рівнів, іон з найменшим атомним номером матиме більший радіус. Наприклад, іони 13Ал3+, 12мг2+, 11В1+, 9F-1, 8О2- і 7N-3, всі мають 10 електронів і 2 електронні рівні. Але найбільший радіус має 7N-3, оскільки він має найменший атомний номер (Z = 7).
* Ковалентний зв’язок: Коли два атоми утворюють ковалентний зв’язок, якщо два атоми рівні, як у випадку з воднем (H2), можна говорити про ковалентний радіус (r), який становить половину довжини зв'язку (d), тобто половину відстані, що розділяє два ядра. Хоча, якщо зв’язок здійснюється різними атомами, як у випадку хлористого водню (HCl), довжина або відстань (d) буде сумою ковалентних радіусів (r1 + r2) атомів, що беруть участь у ковалентності.
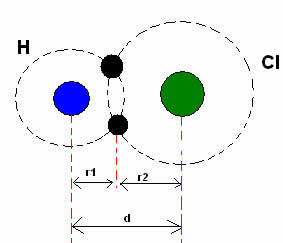
Сума атомних радіусів у ковалентному зв’язку.
Звичайно, ми повинні пам’ятати, що це питання набагато складніше, оскільки ковалентний радіус атома може змінюватися в міру зв’язку з іншими різними атомами.
Дженніфер Фогача
Закінчив хімію
Джерело: Бразильська школа - https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm

