THE теорія октету був запропонований Ньютоном Льюїсом, який у дослідженнях спостерігав, що відбувається атомна взаємодія так що кожен елемент набуває електронної стійкості благородного газу, тобто вісім електронів в валентний шар. Однак у деяких молекулах відбувається те, що називається розширенням або скороченням октету, тобто центральний атом встановлює більш-менш передбачувані зв’язки.
Читайте також: Ковалентний зв’язок - класифікації та характеристики
Як працює теорія октетів?
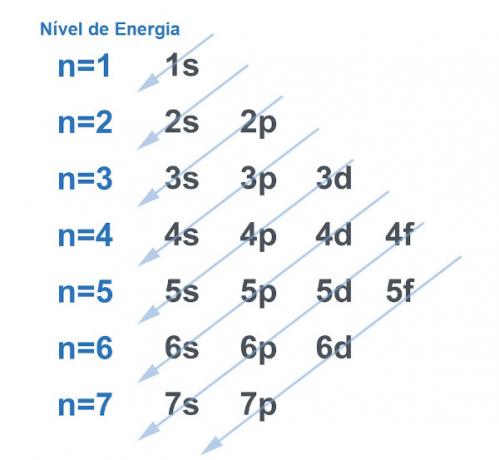
Звичайно, всі системи, як правило, шукають шлях до набути якомога більше стійкості, і це нічим не відрізняється від атома. Атоми - це «базові частинки» будь-якої речовини, і кожна з них має в своєму розпорядженні електросферу. Ця електросфера була розділена на Лінус Полінг на енергетичних рівнях та підрівнях. Полінг розробив схему, щоб продемонструвати, як виглядатиме розподіл електронів навколо ядра атома.
Дивіться зображення нижче:

Кожен рівень і підрівень містять кількість електрони
. Зробивши аналогію, можна сказати, що кожен рівень є полицею, а кожен підрівень - коробкою. У кожну коробку помістіть два електрони. Атом стабільний, коли всі його електрони спарені, тобто коли є всі коробки з двома електронами в кожному.Приклад:
Зробимо електронний розподіл кисню (О), який має у своєму природному стані вісім електронів.

Зверніть увагу, що у валентному шарі (L-шар, у p-підрівні) ми маємо два непарні електрони. Саме ці електрони встановлюють хімічні зв’язки з іншими елементами прагнуть сформувати електронні пари.
Теорія октетів базується на математиці підсумовування електронів. Якщо всі підрівні останньої електронної оболонки мають по два електрони, валентна оболонка матиме загалом вісім електронів і, отже, атом буде стабільним.
Читайте також: Квантові числа - числа, пов'язані з кількістю енергії електрона
благородні гази
Благородні гази - це єдині елементи, які можна зустріти в природі в одноатомній формі, тобто без встановлення зв’язку з іншим атомом. Це тому, що вони мають електронну стабільність. Майже всі вони мають вісім електронів у валентній оболонці., підкоряючись правилу октету, за винятком газу гелію, який має лише два електрони.

Винятки з теорії октетів
Деяким сполукам вдається стабілізуватися з більш-менш восьми електронами у валентній оболонці. У цих випадках трапляються винятки з теорії октету.
розширення октету
Це відбувається головним чином з фосфором (P) та сіркою (S), які є відносно великими атомами та мають підрівень “d”. У цьому випадку атом утримує більше восьми електронів в останній оболонці.
Приклад:

У разі гексафториду сірки центральний елемент залишився 12 електронів, перевищуючи 8, необхідні для стабілізації відповідно до правила октету. У цьому випадку відбулося розширення октету.
скорочення октету
Буває з берилієм (Be), бором (B) та деякими оксиди азоту. Див. Приклад:

У разі трифториду бору атоми фтору набувають необхідних восьми електронів у валентній оболонці шляхом обміну електронний з бором, дотримуючись правила октету, але центральний атом (бор) не стабілізується за допомогою шести електронів, таким чином виникаючи один скорочення октету.
Також доступ: Класифікація сигма-посилання: які критерії?
Вправи вирішені
питання 1 - (Mackenzie-SP) Щоб атоми сірки та калію набули електронну конфігурацію, рівну конфігурації благородного газу, необхідно:
(Дані: атомний номер S = 16; K = 19.)
А) сірка отримує 2 електрони, а калій - 7 електронів.
Б) сірка дає 6 електронів, а калій - 7 електронів.
В) сірка дає 2 електрони, а калій - 1 електрон.
Г) сірка отримує 6 електронів, а калій - 1 електрон.
Д) сірка отримує 2 електрони, а калій - 1 електрон.
Дозвіл
Альтернатива Е. Сірка є елементом колони 16 або сімейства 6А. Елементи цього сімейства, як правило, отримують два електрони, утворюючи електронні пари, і мають у загальній складності вісім електронів у валентній оболонці. Елементи сімейства 1А, які є лужними металами, мають лише один електрон у валентній оболонці. Пожертвуючи цим електроном, попередній шар стає валентним шаром, вже з вісьмома електронами, як диктує правило октету.
Питання 2 - Судіть наступні твердження як істинні (T) або хибні (F).
I () Правило октету говорить, що у валентній оболонці потрібно вісім електронів, щоб атом був стабільним.
II () Валентний шар - це другий електронний шар атома.
III () Хлор (Cl), з сімейства галогенів, має тенденцію отримувати два електрони, щоб набути стійкості.
IV () Натрій (Na), елемент сімейства 1A, як правило, втрачає єдиний електрон у своїй валентній оболонці.
Позначте правильну альтернативу:
А) I, III та IV правдиві.
Б) I та IV - це правда.
В) Тільки II правда.
Г) Тільки IV є хибним.
Д) Всі правда.
Дозвіл
Альтернатива Б. I та IV - це правда. Твердження II є неправильним, оскільки валентний шар є останнім електронним шаром атома, а не другим. А твердження III говорить, що хлор має тенденцію отримувати два електрони, що не перевіряється, оскільки хлор походить Сімейства 7А або 17, як правило, отримують лише один електрон, щоб таким чином набути електронної конфігурації газу благородний.
Автор: Лайса Бернардес, Marques de Araújo
Вчитель хімії