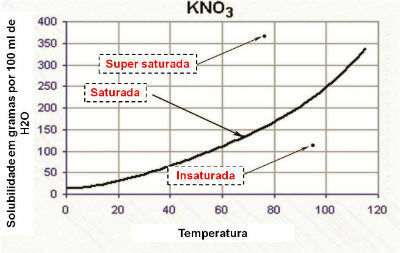
- Нейтральне середовище:
Середовище вважається нейтральним, якщо воно має таку саму концентрацію іонів гідронію (H3О+) і гідроксид (ОН-).
Прикладом нейтрального середовища, яке навіть є стандартом для інших розчинів, є чиста дистильована вода при температурі 25ºC. При цій температурі він має рівно 1. 10-7 моль/л обох іонів. Отже, ваш іонний твір (Кw) дорівнює 10-14 (моль/л)2:
Кw = [H3О+]. [о-]
Кw = (1. 10-7 моль/л). (1. 10-7 моль/л) = 10-14 (моль/л)2
Нижче наведено pH і pH:
pH= - log [H3О+] pOH= -log[OH-]
pH= - log 1. 10-7 pOH= - журнал 1. 10-7
рН = 7pOH = 7
Це показує нам, що в нейтральному розчині рН дорівнює рОН.
- Кислотне середовище:
У кислому середовищі концентрація іонів Н3О+ більше, ніж у іонів ОН-.
Такого розчину можна досягти, додавши невелику частину іонів Н3О+, наприклад, за допомогою кислоти.
Відповідно до принципу Ле Шательє, коли в системі, що знаходиться в рівновазі, викликається порушення, вона прагне переналаштуватися, щоб зменшити дію цієї сили. Це означає, що якщо до води додати кислоту, іони Н
3О+ їх буде надлишок, і рівновага зрушиться в зворотному напрямку реакції, вліво. Таким чином, ці надлишки іонів будуть реагувати з іонами ОН-. Таким чином, концентрація іонів ОН- зменшиться і розчин стане кислим.Не зупиняйся зараз... Після реклами ще більше ;)

Йонний добуток (Kw) завжди дорівнює 10-14, але концентрація іонів Н3О+ більше, ніж концентрація іонів ОН-1. Отже, рН більше, ніж рОН у кислому середовищі, але його сума завжди дорівнює 14.
Крім того, тим більше концентрація іонів Н3О+, тим більше значення pH. При кімнатній температурі (25°C), pH < 7 і pOH > 7.

- Основні засоби:
В основному середовищі концентрація іонів ОН- більше, ніж у іонів Н3О+.
Якщо ми додаємо основу до води, це означає, що ми додаємо іони ОН.- і, як пояснювалося в попередньому пункті, за принципом Ле Шательє, рівновага реакції самоіонізація води буде рухатися в протилежному напрямку, при цьому надлишок іонів реагує з іони Н3О+, зменшуючи концентрацію та роблячи розчин основним.
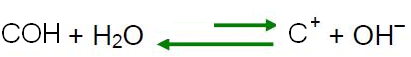
У цьому випадку рОН буде більшим за рН. При кімнатній температурі (25°C), pH > 7 і pOH < 7.

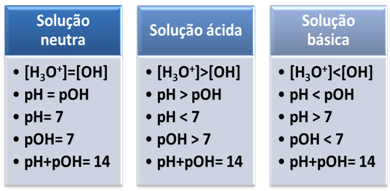
коротко:
Автор: Дженніфер Фогаса
Закінчив хімію
Чи хотіли б ви посилатися на цей текст у шкільній чи академічній роботі? Подивіться:
ФОГАЧА, Дженніфер Роша Варгас. «Нейтральні, кислі та основні середовища»; Бразильська школа. Доступний у: https://brasilescola.uol.com.br/quimica/meios-neutro-acido-basico.htm. Доступ 27 липня 2021 року.