Ковалентний зв’язок це тип взаємодії між атомами, які мають високий електронегативність, тобто висока тенденція до отримання електронів. Хімічними елементами, які зазвичай беруть участь у цьому типі зв’язків, є:
Водень (H)
Берилій (Be)
Бор (B)
Вуглець (C)
Азот (N)
Фосфор (P)
Кисень (O)
Сірка (S)
Фтор (F)
Хлор (Cl)
Бром (Br)
Йод (I)
а) Природа задіяних елементів
Хімічними елементами, що мають високу електронегативність і, отже, здійснюють ковалентні зв’язки, є:
Гідроген
Аметали
б) Виникнення ковалентного зв’язку
Залежно від природи хімічних елементів, що беруть участь у ковалентному зв’язку, це може відбуватися наступним чином:
Між двома атомами водню;
Між атомом неметалу та воднем;
Між атомами одного і того ж хімічного елемента (неметалу);
Між атомами різних хімічних елементів (обидва неметали).
в) Кількість електронів, яку повинен отримати кожен атом
Кількість електронів, яку кожен атом неметалу або водню отримує у зв'язку, пов'язана з правило октету.
Відповідно до правила октету, атом стабільний, коли він набуває у валентній оболонці вісім чи два електрони (лише у випадку Гідрогену). Наприклад, якщо у атомі у валентній оболонці є п’ять електронів, він повинен отримати три електрони для досягнення стійкості.
ПРИМІТКА. Берилій та бор є винятки з правила октету, оскільки вони стають стабільними відповідно з 4 та 6 електронами у валентній оболонці.
Кількість електронів у валентній оболонці можна легко визначити, проаналізувавши сімейство хімічних елементів. У таблиці нижче ми маємо кількість електронів у валентній оболонці, що відноситься до сімейства, до якого належить елемент, і кількість електронів, яке йому потрібно отримати для досягнення стабільності:

г) Принцип ковалентного зв’язку
Як і в ковалентному зв’язку, усі задіяні атоми мають тенденцію отримувати електрони, обов’язково, між ними відбуватиметься розподіл електронів, що знаходяться у валентній оболонці (найдальший від ядра рівень).
Спільний доступ відбувається, коли електрон з валентної оболонки атома стає частиною тієї самої електронної хмари, яка оточує інший електрон з валентної оболонки іншого атома.
Наприклад, кожен атом водню має електрон у валентній оболонці. Коли два електрони стають частиною однієї і тієї ж хмари, кожен водень починає мати два валентних електрона, тобто стабілізується.
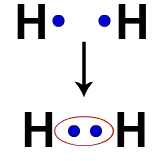
Електрони двох атомів водню, що займають одну і ту ж електронну хмару
д) Формули, що використовуються при ковалентному зв’язку
1ª) молекулярна формула
Це вказівка на кількість атомів кожного елемента, що утворюють молекулу, що походить із ковалентних зв’язків.
Приклад: H2О
У молекулі води ми маємо 2 атоми водню і 1 атом кисню.
2ª) структурна формула
Структурна формула - це демонстрація організації молекули, тобто вона демонструє зв’язки між атомами. Для цього використовуються тире, що представляють зв'язок кожного атома:
Простий (?): Вказує, що атом поділяв лише один електрон зі своєї валентної оболонки з іншим атомом і навпаки;
Подвійний (?): Вказує, що атом розділив два електрони з валентної оболонки з іншим атомом і навпаки;
Потрійний (≡): вказує на те, що атом поділив три електрони зі своєї валентної оболонки з іншим атомом і навпаки.
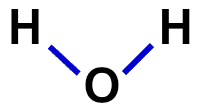
Структурна формула води
3ª) Електронна формула Льюїса
Електронна формула Льюїса також представляє організацію молекули (електронна формула), але вона має на меті продемонструвати розподіл електронів в атомах.
Для його побудови нам просто потрібно поважати організацію, запропоновану в структурній формулі, і замінити кожен слід зв’язків (одинарний, подвійний або потрійний) на „дві кульки”, які представляють електрони.
Наприклад, у структурній формулі води ми маємо два простих зв’язки між Гідрогеном та Оксигеном. Таким чином, між ними ми матимемо лише два кулі, відокремлені еліпсом (що представляє електронну хмару).
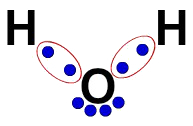
Електронна формула води Льюїса
Мені Діого Лопес Діас
Джерело: Бразильська школа - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-covalente.htm