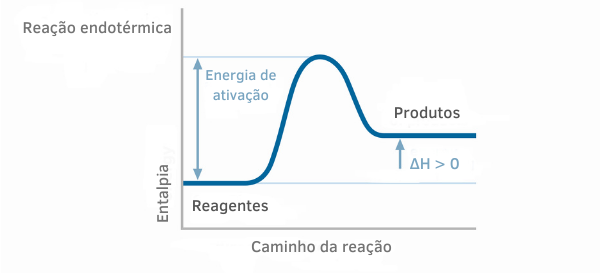
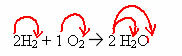ентальпія - це кількість енергії в даній реакції, варіація Ентальпії стосується походження цієї енергії. Наприклад, якщо енергія походить від реакції синтезу (переходу речовини з твердого стану в рідину), ми матимемо Ентальпію плавлення. Є кілька типів ентальпії, див. Нижче:
Ентальпія формації: чи підтверджена зміна ентальпії при утворенні 1 моль молекул даної речовини у стандартному стані (в умовах навколишнього середовища (25 ° C та 1 атм) та у більш стабільному алотропному стані). Давайте розглянемо воду як цю речовину:
H2 (g) + ½ O2 (g) → 1 год2O (l) ∆Hf = -68,3 Ккал / моль
Ентальпія утворення води (H2О) становить -68,3 Ккал / моль, це значення відповідає отриманню 1 моль Н2O (l) через елементи у стандартному стані.
Ентальпія нейтралізації: значення, отримане внаслідок теплоти, поглиненої при нейтралізації 1 моль OH- (водн.) з 1 моль H + (водн.), будучи їх у розведених водних розчинах.
H+ (aq) + OH- (aq) → H2(1) ∆H = -13,8 Ккал / моль
ентальпія розчинення: - теплота, що виявляється при розчиненні 1 моль розчиненої речовини в розчиннику, у кількості, достатній для отримання розведеного розчину.
HCl (g) + H2O (1) → H30+(aq) + Cl- (aq) ∆H = -18,0 Ккал / моль
Наведене вище рівняння представляє ентальпію розчинення соляного газу.
Не зупиняйтесь зараз... Після реклами є ще щось;)
Ентальпія горіння: - теплота, що поглинається при загальному згорянні 1 моль речовини в умовах навколишнього середовища (25 ° C і 1 атм). При згорянні виділяється тепло, воно відбувається між паливом та окислювачем, паливом може бути будь-яка речовина, основним окисником є кисень.
1 СН4(g) + 2 O2(g) → CO2(г) + 2 год2O (1) ∆H = - 212,8 Ккал / моль
Значення - 212,8 Ккал / моль відноситься до спалювання 1 моль метану СН4(g) в умовах навколишнього середовища 25 ° C і тиску 1 атм.
Ентальпія затвердіння: відповідає зміні ентальпії загального затвердіння 1 моль речовини при тиску 1 атм.
H2O (1) → H2O (s) Δ H = - 1,7 Ккал / моль
Ентальпія конденсату: посилання на зміну ентальпії загальної конденсації 1 моль речовини при тиску 1 атм.
H2O (v) → H2O (l) Δ H = - 10,5 Ккал / моль
Ентальпія плавлення: зміна ентальпії загального плавлення 1 моль речовини під тиском 1 атм.
H2O (s) → H2O (l) Δ H = + 1,7 Ккал / моль
ентальпія випаровування: відповідає зміні ентальпії загального випаровування 1 моль речовини під тиском 1 атм.
H2O (1) → H2O (v) Δ H = + 10,5 Ккал / моль
Лірія Алвес
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
СУЗА, Лірія Алвес де. "Ентальпійна варіація реакцій"; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/variacao-entalpia-nas-reacoes.htm. Доступ 28 червня 2021 року.