В ізотермічному перетворенні зміна об'єму та тиску певного газу, але постійна температура; звідси походження ізотермічної назви (грец. ізо = рівний; термо = тепло).
Вчені Бойл та Маріотт, ізольовано, провели подібні експерименти, і отриманий результат був: із збільшенням тиску об'єм газу зменшується.
Подумайте, наприклад, про поршень шприца. Якщо ми застосуємо зовнішній тиск на цей плунжер, тобто якщо ми збільшимо тиск, об’єм повітря, зайнятого всередині шприца, зменшиться, і навпаки.
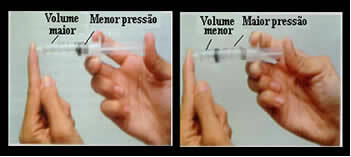
Об'єм і тиск обернено пропорційні: на лівій панелі тиск малий, а об'єм, який займає повітря, великий. Праворуч, коли на поршень шприца застосовується більший тиск, об’єм зменшується.
Це не поодинокий випадок, це те, що повторюється із загальною регулярністю для газів. Отже, цей факт був викладений у формі закону, який можна описати наступним чином:
| закон Бойля або Закон Бойля-Маріотта: При постійній температурі об'єм, зайнятий фіксованою масою газу, обернено пропорційний його тиску. |
Це означає, що якщо ми подвоїмо тиск газу, його об’єм зменшиться вдвічі тощо. Коли дві такі величини обернено пропорційні, їх добуток є константою; отже, математично цей зв'язок можна представити наступним чином:
Не зупиняйтесь зараз... Після реклами є ще щось;)
| P.V = k |
Де k = постійна.
Отже, якщо в першій ситуації ми маємо значення тиску певного газу як P1, а його відповідний об’єм як V1, то ми повинні:
| P1. V1 = k |
Якщо ми збільшимо цей тиск до Р2, його об'єм також буде змінено на V2, і знову нам доведеться:
| P2 . V2 = k |
Таким чином, ми дійшли висновку:
| P1. V1 = Р2. V2 |
Цю сталість можна побачити на прикладі, наведеному в таблиці нижче, тисків та об’ємів газу з фіксованою масою:
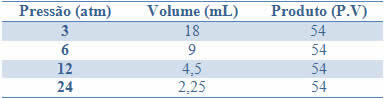
Графікуючи ці значення, ми побачимо формування кривої.
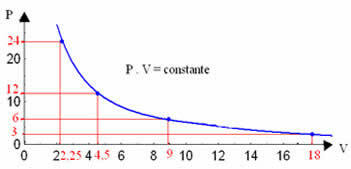
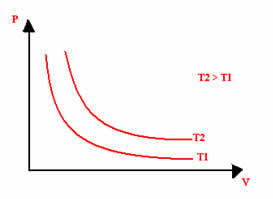
Графічне зображення ізотермічного перетворення завжди буде гіперболою, незалежно від значень тиску та об'єму та температури, при яких проводився експеримент. Ця гіпербола називається ізотерма; отже, як видно на графіку нижче, різні температури породжують різні ізотерми.
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. «Ізотермічне перетворення або закон Бойля»; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm. Доступ 27 червня 2021 року.