Розглянемо загальну оборотну реакцію нижче, де малі літери відповідають збалансованим коефіцієнтам реакції, а великі букви - це реагенти, а всі продукти газоподібні:

Розглядаючи кожен із напрямків реакції окремо, швидкість їх розвитку (Td) визначається як:
* Пряма реакція: aA + bB → cC + dD
Всіпрямий = Кпрямий. [THE]. [B]B
* Зворотна реакція: cC + dD → aA + bB
Всізворотний = Кзворотний. [Ç]ç. [D]d
Постійна хімічної рівноваги щодо концентрації у кількості речовини (Kç) і з точки зору парціального тиску (KP) буде отримано діленням Kпрямий від К.зворотний.
Отже, маємо:
Кпрямий. [THE]. [B]B = 1 → Кпрямий__ = __[Ç]ç. [D]d___
Кзворотний. [Ç]ç. [D]d Кзворотний [THE]. [B]B
Буття, Кç =_Kпрямий_
Кзворотний
Отже, маємо:
Кç =__[Ç]ç. [D]d___ або КP =__(Праса)ç. (pD)d___ |
Де p - парціальний тиск кожної речовини в рівновазі.
Таким чином, кожна концентрація підвищується до показника, що відповідає коефіцієнту відповідної речовини в реакції, і Kç не має одиниці *.
Крім того, дуже важливим аспектом, який слід виділити, є той, що в цьому виразі
не повинні бути представлені ні тверді компоненти, ні чисті рідини., оскільки в цьому виразі беруть участь лише речовини, які можуть зазнати змін. Концентрація в кількості речовини речовини у твердому стані є постійною і, отже, вже включена у значення самого К.ç. Те саме стосується чистих рідин, таких як вода. Коротко, в експресії беруть участь лише речовини в газоподібному стані та у водному розчині.Не зупиняйтесь зараз... Після реклами є ще щось;)
Зверніть увагу на приклади нижче:
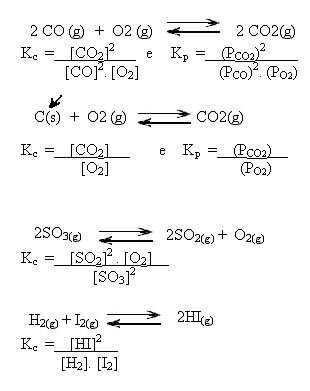
Значення Kç може показати нам, чи однакові концентрації реагентів і продуктів, чи одна з них більша за іншу
- якщо Кç або КP дорівнює одиниці (Kç = 1), це означає, що концентрація реагентів і продуктів рівна;
- якщо значення Кç або КP бути високим, це означає, що продукти перебувають у більшій концентрації, оскільки при вираженні Kç товари знаходяться в числівнику;
- якщо значення Кç або КP низький, це означає, що реагенти мають вищу концентрацію, оскільки при експресії Kç реагенти знаходяться в знаменнику.
* Кç і К.P це безрозмірні числа, тобто чисті числа, без одиниці виміру, пов'язаної з якою-небудь величиною або відношенням між величинами.
Дженніфер Фогача
Закінчив хімію
Хотіли б ви посилатися на цей текст у школі чи академічній роботі? Подивіться:
FOGAÇA, Дженніфер Роша Варгас. "Константи рівноваги Kc і Kp"; Бразильська школа. Доступно: https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm. Доступ 28 червня 2021 року.