Розчинена речовина та розчинник - це два компоненти однорідної суміші, яка називається хімічним розчином.
- Розчинена речовина: - речовина, яка диспергована у розчиннику. Він відповідає речовині, яка розчиняється, і, як правило, він знаходиться в меншій кількості в розчині.
- Розчинник: це речовина, в якій розчинена речовина буде розчинена, утворюючи новий продукт. У більшій кількості він присутній у розчині.
Розчинення між розчиненою речовиною (дисперсною) та розчинником (диспергатором) відбувається за рахунок взаємодій між їх молекулами.
Різниця між цими двома компонентами розчину полягає в тому, що розчинена речовина - це речовина, яка розчиняється, а розчинник - речовина, яка впливатиме на розчинення.
Найвідомішим розчинником є вода, яка вважається універсальний розчинник. Це тому, що він має здатність розчиняти велику кількість речовин.
Приклади розчинників та розчинників
Перегляньте кілька прикладів хімічних розчинів та відкрийте розчинені речовини та розчинники кожного з них:
Вода і сіль
- Розчинена речовина: кухонна сіль - хлорид натрію (NaCl)
- Розчинник: вода
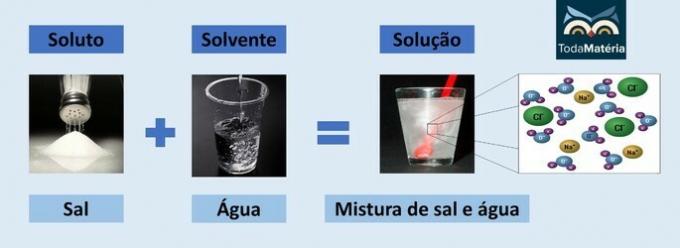
Оскільки це іонна сполука, хлорид натрію в розчині дисоціює і утворює іони, які, в свою чергу, сольватовані молекулами Вода.
Позитивний полюс води (H+) взаємодіє з аніоном солі (Cl-) і негативний полюс води (O2-) взаємодіє з катіоном (Na+).
Це різновид електролітичного розчину, оскільки іонні форми в розчині здатні проводити електричний струм.
води та цукру
- Розчинена речовина: Цукор - Сахароза (C12H22О11)
- Розчинник: вода

Цукор є ковалентною сполукою і при розчиненні у воді молекули вони розходяться, але не змінюють свою ідентичність.
Цей водний розчин класифікується як неелектролітичний, оскільки розчинена у розчині розчинена речовина є нейтральною і, отже, не реагує з водою.
Оцет
- Розчинена речовина: оцтова кислота (СН3COOH)
- Розчинник: вода

Оцет - це розчин, що містить щонайменше 4% оцтової кислоти, а карбонова кислота який, будучи полярним, взаємодіє з водою, також полярною, через водневі зв’язки.
Важливим правилом розчинності є те, що подібне розчиняється подібне. Полярні сполуки розчиняються в полярних розчинниках, тоді як неполярні речовини розчиняються в неполярних розчинниках.
Інші рішення
Крім рідких розчинів існують також газоподібні та тверді розчини.
Повітря, яким ми дихаємо, є прикладом газоподібного розчину, газами якого у більшій кількості є азот (78%) та кисень (21%).
В металеві сплави це тверді розчини. Наприклад, латунь (цинк та мідь) - це суміш, яка використовується для виготовлення музичних інструментів.
Хочете отримати більше знань? Тож прочитайте ці інші тексти:
- Хімічні розчини
- міжмолекулярні сили
- Однорідні та неоднорідні суміші
Що таке коефіцієнт розчинності?
Коефіцієнт розчинності - це межа розчиненої речовини, що додається до розчинника при даній температурі з утворенням насиченого розчину.
О коефіцієнт розчинності змінюється залежно від умов і може збільшуватися або зменшуватися залежно від зміни температури та розчиненої речовини.
Існує межа, до якої розчинник може здійснювати розчинення.
Приклад: Якщо ви покладете цукор у склянку з водою, ви в перший момент помітите, що цукор зникає у воді.
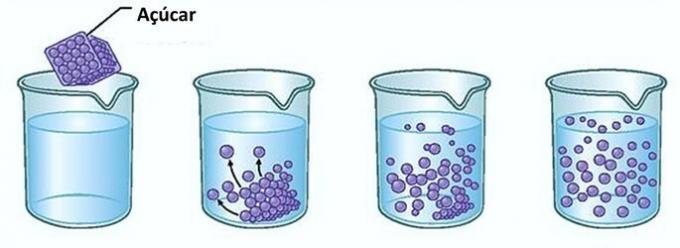
Однак якщо ви продовжите додавати цукор, то виявите, що в якийсь момент він почне накопичуватися на дні склянки.
Це тому, що вода, яка є розчинником, досягла межі розчинність і максимальна кількість концентрації. Розчинена речовина, яка залишається на дні ємності і не розчиняється, називається фон тіла.
Надлишок цукру на дні склянки не розчиниться і не вплине на концентрацію розчину. Крім того, цукор, що осідає на дні склянки, не зробить воду солодшою.
Класифікація розчинів
Розчини можна класифікувати за кількістю розчиненої розчиненої речовини. Таким чином, вони можуть бути трьох типів: насичені, ненасичені та пересичені.
- насичений розчин: Розчин досяг межі коефіцієнта розчинності, тобто є максимальна кількість розчиненої речовини, розчиненої в розчиннику при певній температурі.
- ненасичений розчин: Кількість розчиненої розчиненої речовини ще не досягла коефіцієнта розчинності. Це означає, що можна додати більше розчиненої речовини.
- пересичений розчин: Розчиненої речовини більше, ніж за звичайних умов. У цьому випадку вони представляють осад.
Щоб дізнатись більше про рішення, прочитайте наступні тексти.:
- Розведення розчинів
- Моляльність
- Молярність
- Титрування
Концентрація розчинів
За розчиненою речовиною та розчинником можна розрахувати концентрацію розчину.
Загальна концентрація визначається як відношення маси розчиненої речовини, розчиненої в заданому об'ємі розчину.
Розрахунок концентрації проводиться за такою формулою:
Бути,
Ç: Концентрація (г / л);
м: маса розчиненої речовини (г);
V: об'єм розчину (L).
Приклад:
(Faap) Обчисліть концентрацію водного розчину нітрату натрію, що містить 30 г солі, у 400 мл розчину, в г / л:
Дозвіл:
Дотримуйтесь інформації щодо кількості розчиненої речовини та розчинника. У 400 мл водного розчину (розчинника) міститься 30 г солі (розчиненої речовини).
Однак об'єм у мл, і нам потрібно перетворити його на L:
Тепер, щоб знати концентрацію, вам просто потрібно застосувати формулу:
Отримавши цей результат, ми дійшли висновку, що коли ми змішаємо 30 г солі з 400 мл води, ми отримаємо розчин з концентрацією 75 г / л.
Для отримання додаткової інформації про те, як розрахувати загальну концентрацію, ці тексти будуть корисними.:
- Концентрація розчину
- Вправи на загальну концентрацію

