THE осмотичний тиск це колігативна властивість, яка відповідає тиску, який необхідно чинити на систему, щоб запобігти спонтанному виникненню осмосу.
Осмос - це проходження води з менш концентрованого (гіпотонічного) до більш концентрованого (гіпертонічного) середовища через напівпроникну мембрану до досягнення рівноваги.
Щоб осмос не запускався і не відбувався природним шляхом, необхідно застосовувати зовнішній тиск на більш концентрований розчин, не допускаючи проходження розчинника до більш концентрованого середовища. Це осмотичний тиск.
Чим концентрованіший розчин, тим більшим повинен бути осмотичний тиск. Отже, осмотичний тиск пропорційний концентрації розчиненої речовини.
Як розрахувати осмотичний тиск?
Кожен розчин має різне значення осмотичного тиску. Осмотичний тиск можна розрахувати за такою формулою:
π = М. А. Т. i
Де ми маємо такі змінні:
π = осмотичний тиск;
М = концентрація в моль / л;
R = універсальна газова константа, значення якої відповідає 0,082 атм. Л. моль-1. К-1 або 62,3 мм рт.ст. моль-1. К-1;
T = температура за абсолютною шкалою (Кельвін);
i = коефіцієнт Ванн-Гоффа, який включає залежність між загальною кількістю кінцевих та початкових частинок в іонних розчинах.
Вправа вирішена
1. (Puccamp-SP) Іноді розчин глюкози 0,30 М використовують для внутрішньовенних ін’єкцій, оскільки він має осмотичний тиск, близький до тиску крові. Який осмотичний тиск у атмосферах згаданого розчину при 37 ° С?
а) 1,00.
б) 1,50.
в) 1,76.
г) 7,63.
д) 9,83.
Беручи до уваги дані, задані питанням, ми маємо:
М = 0,30 моль / л;
R = 0,082 атм. Л. моль-1. К-1
Т = 37 ° + 273 = 310 К
Тепер потрібно застосувати ці значення до формули для розрахунку осмотичного тиску:
π = М. А. Т. i
π = 0,30. 0,082. 310
π = 7,63 атм (Альтернатива)
Класифікація розчинів
Розчини можна класифікувати на три типи за осмотичним тиском:
- гіпертонічний розчин: Має вищий осмотичний тиск і концентрацію розчиненої речовини.
- ізотонічний розчин: Коли розчини мають однаковий осмотичний тиск.
- гіпотонічний розчин: Має нижчий осмотичний тиск і концентрацію розчиненої речовини.

Значення осмотичного тиску для живих істот
Фізіологічний розчин - це речовина, приготована на основі принципів осмотичного тиску. Його слід застосовувати при осмотичному тиску, рівному знаходженню в організмі, це заважає Червоні клітини не страждайте гемолізом і не зморщуйтесь.
Осмотичний тиск крові становить приблизно 7,8 атм. Отже, для правильного функціонування організму еритроцити повинні мати однаковий осмотичний тиск, забезпечуючи нормальний приплив води в клітини та з них.
Наприклад, у випадках зневоднення показано застосування сольового розчину, який повинен бути ізотонічним щодо клітин крові та інших рідин організму.
Сольовий розчин має функцію повернення осмотичного балансу всередині організму. Це тому, що під час зневоднення кров стає більш концентрованою, ніж всередині клітин, змушуючи їх в’янути.
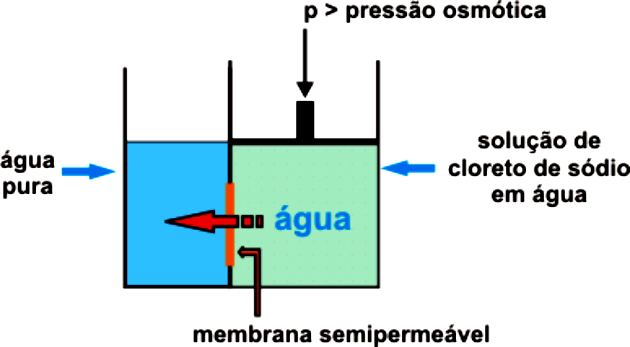
Осмос та зворотний осмос
Як ми вже бачили, осмос це процес пропускання води з гіпотонічного в гіпертонічне середовище через напівпроникну мембрану до досягнення рівноваги між концентраціями.
Тим часом, зворотний осмос це процес відділення речовин через мембрану, яка утримує розчинену речовину. Розчинник перетікає з більш концентрованого середовища в менш концентроване і виділяється з розчиненої речовини мембраною, яка дозволяє його проходити.
Це відбувається лише через тиск, що робить напівпроникну мембрану лише пропуском води, утримуючи розчинену речовину. Цей тиск повинен бути більшим за природний осмотичний тиск.
Наприклад, якщо осмотичний тиск більший за необхідний, відбудеться зворотний осмос. Таким чином, потік перейде від середовища з найбільшою концентрацією до середовища з найнижчою концентрацією.