Метали - це елементи, що характеризуються яскравістю, міцністю, тепловою та електропровідністю. Вони є застосовується практично у всіх промислових процесах, присутні в металевих сплавах, що використовуються у виробництві інструментів, ювелірних виробів та монет, а також у хімічних процесах, таких як окисно-відновний, що відповідають за роботу стеки та акумулятори.
У Періодичній системі вони класифікуються на:
напівметалів
перехідних металів
лужні метали
лужноземельні метали
У металургійній промисловості їх поділяють на:
чорні метали
кольорові метали
важкі метали
Читайте також: Які нові елементи періодичної системи?
Характеристики металу

Здебільшого вони є чудовими провідниками тепла та електрики.
Вони мають глянцевий вигляд.
мають високі щільність.
Вони є електропозитивними елементами (вони, як правило, утворюють катіони - позитивні заряди).
За винятком Меркурій, це елементи з високою температурою плавлення і тверді при кімнатній температурі.
Вони мають механічну міцність (міцність).
Вони податливі (можна формувати, не ламаючи).
Не зупиняйтесь зараз... Після реклами є ще щось;)
Періодична система металів
лужні метали
Є елементами перша колонка періодичної системи, сім’я 1А. Їх називають лужними металами, оскільки при змішуванні з водою вони утворюють гідроксиди, тобто лужний (основний) розчин.
ти елементів до цієї групи належать:
Літій (лі)
Натрію (В)
Калій (К)
Рубідій (Rb)
Цезій (Cs)
Францій (Fr)
Електронна конфігурація лужних металів у нейтральному (незарядженому / іонізованому) стані представлена лише електрон в останній оболонці (валентний шар). О атомний промінь а реакційна здатність цих металів зростає зверху вниз (спостерігаючи Періодична таблиця). Вони мають низьку температуру плавлення в порівнянні з іншими металами, податливі і не дуже щільні, мають матовий вигляд завдяки високий окислювальний потенціал.
Дивіться також:Які властивості речовини?
лужноземельні метали
Це елементи, які відображаються в друга колонка періодичної системи, сім'я 2А. називаються лужноземельна за тенденцією до утворення розчинів основного (лужного) характеру і за землею, оскільки до 19 століття оксиди, що утворюються цими речовинами, позначалися саме так. Цей термін використовувався для позначення нерозчинних металів, які не зазнали мутації при нагріванні, загальних характеристик елементів 2 групи. Пізніше, у світлі нових досліджень та експериментів, було виявлено, що «земні» елементи насправді були оксидами, утвореними металами.
Вони є ковкими металами, мають низьку щільність два електрони в її зовнішній оболонці, знаходяться в звичайних умовах температури і тиску в твердому стані. Належить до цієї групи:
Берилій (Будь)
Магній (Мг)
Кальцій (Тут)
Стронцій (пан)
Барій (Ba)
Радіо (Жаба)
перехідних металів
складають група В Періодичної системи, і розташовані між лужноземельними металами та металів. Вони були визначені IUPAC як елементи, що мають неповний енергетичний підшар. Термін "перехідних металів" відноситься до перехід від групи 2 до 13 в Періодичній системі та зростаюче додавання електронів на d-орбіталі.
Група перехідних металів складається з щільних елементів, що мають високі температури плавлення і кипіння, і менш реактивний, ніж метали групи 1 та 2 (Сім'я 1А та 2А). Серед перехідних металів є вольфрам, який є елементом з найвищою температурою плавлення (3422 ° C), і ртуть (Hg), яка являє собою метал, який є рідким при нормальних умовах температури і тиску, його температура плавлення (-38,83 ° C).
Перехідні метали мають різні ступені окислення (NOX змінний) і утворюють кольорові речовини.

Внутрішні перехідні елементи
Внутрішні перехідні елементи вони є:
Лантаніди: ряди, що складаються з елементів, що мають від 57 до 71 протона і які, за винятком прометію, є природними.
Актиніди: група, утворена елементами в атомному номері від 89 до 103 і які, здебільшого, є синтетичними. Вся ця група є радіоактивний з коротким періодом напіввиведення.
Елементи цих двох груп мають високу температуру плавлення і всі вони тверді при кімнатній температурі.
Напівметали
ти напівметалів всього є сім елементів:
Бор (B)
Кремній (Si)
Германій (Ge)
Миш'як (As)
Сурма (Пн)
Теллур (Te)
Полоній (Po)
Ця класифікація дається елементам, які мають фізико-хімічні характеристики, що стосуються металів, а також інші, що стосуються неметалевих елементів. Напівметали мають блиск, є крихкими сполуками, здатними утворювати катіони, а також аніони (залежно від стану) і є проміжними провідниками.
Види металів
Чорний: речовини, що містять у своєму складі залізо. Вони є металеві сплави які містять залізо як загальний елемент, але можуть бути складені з різними концентраціями вуглець, наприклад, або ковані з різними техніками, маючи таким чином вироби з різними фізичними властивостями.
Кольорові: сплави, утворені іншими видами металів, такими як алюміній, мідь, нікель, цинку, титан.
Важкі метали: свинець, нікель, цинк, ртуть. Це реакційноздатні, токсичні та біоакумулятивні метали. Вони використовуються в батареях, лампах, боєприпасах для військових артефактів, серед іншого.
Хімічні зв’язки металів
Метали є елементів електропозитивні, тобто вони мають тенденцію втрачати електрони в хімічному зв’язку. Коли метал взаємодіє з неметалом, він виконати іонний зв’язок через різницю в електронегативність. Інша можливість скріплення металів - це металеві зв’язки.
В металеві з'єднання виникають між металами, з частковим вивільненням електронів і утворенням хмари або моря електронів навколо атомів, що гарантує металевим деталям властивості провідність електрична та ковкість.
Дивіться також: Провідники та ізолятори - в чому різниця?
Отримання металів
Більшість металів містяться в природі гірські породи та мінерали, пов’язані з іншими елементами. Існує кілька методів очищення металів, наприклад, шляхом електролізу та хімічних реакцій на окремі сполуки.
У випадку з металами двома найбільш використовуваними технологіями в промислових масштабах для отримання певного ступеня чистоти в металі є: різниця щільність і магнітна сприйнятливість (тенденція до того, що метал повинен реагувати на a магнітне поле).

розв’язані вправи
Питання 1 - (Enem) Кадмій, який знаходиться в батареях, може потрапити до землі, коли ці матеріали нерегулярно утилізуються в навколишньому середовищі або коли вони спалюються. На відміну від металевої форми, іони Cd2 + надзвичайно небезпечні для організму, оскільки вони можуть замінити Іони Са2 +, викликаючи дегенеративне захворювання кісток, роблячи їх дуже пористими і викликаючи сильний біль у кістках. суглоби. Вони також можуть інгібувати ферменти, активовані катіоном Zn2 +, які надзвичайно важливі для функціонування нирок. На малюнку показано зміни радіуса деяких металів та їх відповідних катіонів.
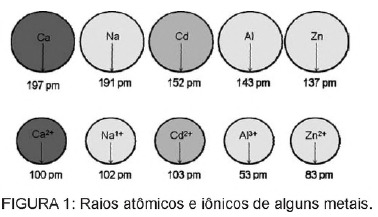
Виходячи з тексту, токсичність кадмію в його іонній формі є наслідком цього елемента
А) має низьку енергію іонізації, яка сприяє утворенню іона та полегшує його зв’язування з іншими сполуками.
Б) мають тенденцію діяти в біологічних процесах, опосередкованих металевими катіонами із зарядами в діапазоні від +1 до +3.
В) мають радіус і заряд відносно близькі до іонів металів, які діють на біологічні процеси, викликаючи втручання в ці процеси.
Г) мають великий іонний радіус, що дозволяє йому втручатися в біологічні процеси, в яких менші іони зазвичай беруть участь.
Д) мають заряд +2, що дозволяє йому втручатися в біологічні процеси, в яких, як правило, беруть участь іони з меншими зарядами.
Дозвіл
Альтернатива C. Кадмій - це елемент, подібний до іонів металів, які ми природно маємо в організмі. Окрім того, що кадмій є біоакумулятивним, маючи таку схожість з металевими групами, він може зв’язуватися з сульфгідрильними групами молекул білка, викликаючи таким чином зміни в біологічних процесах, таких як декальцифікація, і руйнування тканин і еритроцитів крові.
Питання 2 - Для характеристик, що стосуються металів, позначте неправильну альтернативу.
А) Більшість металів є хорошими електричними та тепловими провідниками.
Б) Деякі метали сприйнятливі до окислення та / або відновлення.
В) Залізо - стійкий і ковкий метал, тобто його легко формувати.
Г) Лужноземельні метали мають цю назву “земля”, що стосується оксидів цих металів, які мають темний колір.
Д) Метали - це елементи різноманітних кольорів і тьмяні внаслідок дії окислення.
Дозвіл
Альтернатива Е. Метали мають природний блиск і металевий колір, вони можуть зазнати окислення, що спричиняє зміни характеристик, що мають відношення до аспект деталі, але це не явище, яке трапляється у всіх металах, і, в деяких випадках, окислення залежить від кількох факторів зовнішній.
Лайса Бернардес
Вчитель хімії



