Хімічна кінетика вивчає швидкість хімічних реакцій та фактори, що впливають на швидкість цих реакцій.
Використовуйте запитання нижче, щоб перевірити свої знання та перевірити коментарі до резолюцій.
питання 1
Щодо факторів, що впливають на швидкість хімічної реакції, НЕПРАВИЛЬНО стверджувати, що:
а) Чим вища концентрація реагентів, тим швидша реакція.
б) Чим більше поверхня контакту, тим більша швидкість реакції.
в) Чим вищий тиск, тим швидша реакція.
г) Чим вища температура, тим швидша реакція.
д) Наявність каталізатора підтримує постійну швидкість реакції.
Неправильна альтернатива: д) Наявність каталізатора підтримує постійну швидкість реакції.
Каталізатори збільшують швидкість реакції, оскільки полегшують утворення активованого комплексу між реагентами.
Завдяки цьому каталізатори створюють більш короткий механізм розвитку реакції, що призводить до збільшення швидкості.
питання 2
Відповідно до _____________ для реалізації продуктів між реагентами повинні відбуватися ефективні зіткнення. Крім того, достатньо ___________, щоб розірвати хімічні зв’язки реагентів і утворити ___________, який є проміжним станом до утворення продуктів.
Слова, які правильно заповнюють пропуски, відповідно:
а) ентальпія, кінетична енергія та варіація каталізатора.
б) теорія зіткнень, енергія активації та активований комплекс.
в) швидкість реакції, ентальпія та інгібітор.
г) парціальний тиск, ентропія та підкладка.
Правильна альтернатива: б) теорія зіткнення, енергія активації та активований комплекс.
Згідно з теорією зіткнень, зіткнення між реагентами необхідні для хімічної реакції. Для цього речовини повинні знаходитись у сприятливому положенні, щоб удари були ефективними.
Енергія активації діє як енергетичний бар’єр, який необхідно подолати, щоб розірвати зв’язки реагуючих сполук. Чим менша енергія активації, тим швидша реакція.
Активований комплекс - це нестабільний проміжний вид, що утворюється перед продуктами.
питання 3
Наступні чотири твердження зроблені щодо каталізаторів:
Я Каталізатор працює, збільшуючи швидкість реакції, але він не змінює своїх характеристик.
II. При хімічній реакції каталізатор не витрачається на шляху реакції.
III. Каталізатори створюють альтернативний шлях перетворення реагентів у продукти. Для цього потрібна більша енергія активації.
IV. Каталізатор здатний лише пришвидшити реакцію в прямому напрямку.
Варіанти, які представляють правильну інформацію про каталізатори:
а) I та II
б) II та III
в) I та IV
г) Усі
Правильна альтернатива: а) I та II.
Каталізатори використовують для прискорення хімічних реакцій. Реакція з використанням каталізатора не змінює його вихід, тобто очікувана кількість продукту виробляється, але за менший час.
Під час хімічної реакції каталізатори не витрачаються, вони сприяють утворенню активованого комплексу. Отже, каталізатор можна відновити в кінці хімічної реакції.
Каталізатори здатні зменшити час реакції, створюючи альтернативний механізм утворення продуктів з меншою енергією активації. Тому реакція відбувається швидше.
Каталізатори діють як у прямому, так і в зворотному напрямку реакції.
питання 4
Наскільки швидко відбувається хімічна реакція, залежить від:
Я Кількість ефективних зіткнень між реагентами.
II. Досить енергії, щоб переставити атоми.
III. Сприятлива орієнтація молекул.
IV. Утворення активованого комплексу.
а) I та II
б) II та IV
в) I, II та III
г) I, II, III та IV
Правильна альтернатива: г) I, II, III та IV.
Ефективні зіткнення трапляються, коли реагенти знаходяться в позиціях, сприятливих для ударів, що сприятиме перебудові атомів.
Енергії активації повинно бути достатньо, щоб зіткнення між реагентами призвело до розриву зв’язків та утворення активованого комплексу.
Не всі зіткнення між частинками, що реагують, викликають реакцію. Орієнтація, з якою відбувається зіткнення, важлива для утворення продуктів, що відбуватимуться.
Активований комплекс є проміжним і нестійким станом до утворення продуктів. Він створюється при перевищенні енергії активації реакції.
питання 5
Діоксид вуглецю - це газ, що утворюється в результаті реакції між чадним газом та киснем, згідно з хімічним рівнянням нижче.
CO(g) + ½2 (г) → CO2 (г)
Знаючи, що за 5 хвилин реакції було витрачено 2,5 моль CO, яка швидкість розвитку реакції відповідно до витрати O2?
а) 0,2 моль. хв-1
б) 1,5 моль. хв-1
в) 2,0 моль. хв-1
г) 0,25 моль. хв-1
Правильна альтернатива: г) 0,25 моль. хв-1
Щоб відповісти на це питання, ми повинні розглянути хімічне рівняння.
CO(g) + ½2 (г) → CO2 (г)
Зверніть увагу, що 1 моль оксиду вуглецю реагує з ½ моллю кисню, утворюючи 1 моль діоксиду вуглецю.
Кількість, наведена у заяві, стосується окису вуглецю, але відповідь має бути киснем. Для цього ми повинні виконати правило трьох і знайти кількість кисню.
1 моль CO - ½ моль O2
2,5 моль CO - x O2
х = 1,25 моль
Тепер ми застосовуємо значення у формулі швидкості розвитку реакції.
Отже, швидкість розвитку реакції щодо кисню становить 0,25 моль. Хв-1.
питання 6
Зверніть увагу на графічне зображення розвитку гіпотетичної хімічної реакції, яка пов’язує енергію та шлях реакції.
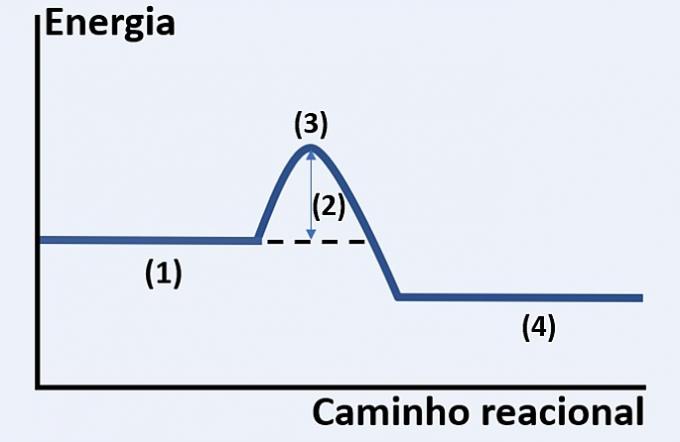
Перевірте варіант, який правильно замінює (1), (2), (3) та (4) відповідно.
а) субстрати, виділене тепло, максимальний енергетичний стан і кінець реакції.
б) реагенти, енергія активації, активований комплекс та продукти.
в) реактиви, кінетична енергія, каталізатор і субстрати.
г) реактиви, поглинене тепло, теплова енергія та продукти.
Правильна альтернатива: б) реагенти, енергія активації, активований комплекс та продукти.
Наведений графік - це ендотермічна реакція, тобто відбувається поглинання енергії, щоб відбулася реакція.
ти реагенти (1) знаходяться на початку графіку та енергія активації (2) відповідає різниці між енергією, що зберігається в реагентах та в комплекс активований (3). Нарешті, після проходження проміжного стану, утворення продуктів (4).
Отже, реагентам потрібно подолати енергію активації, щоб переставити свої атоми в проміжну структуру, яка називається активованим комплексом, щоб утворилися продукти.
питання 7
Речовина А здатна розкладатися і перетворюватися на речовину В. Спостерігайте за розвитком цієї реакції на зображенні нижче.

Щодо швидкості реакції, можна сказати, що:
а) Речовина А розкладається між 0 і 15 с зі швидкістю 0,35 моль. с-1.
б) Речовина А розкладається між 15 і 30 с зі швидкістю 0,02 моль. с-1.
в) Речовина А розкладається між 0 і 15 с зі швидкістю 0,04 моль. с-1.
г) Речовина А розкладається між 15 і 30 с зі швидкістю 0,03 моль. с-1.
Правильна альтернатива: г) Речовина А розкладається між 15 і 30 с зі швидкістю 0,03 моль. С-1.
Швидкість розкладання речовини А можна обчислити за формулою:
Обчислимо швидкість реакції через речовину А між заданими інтервалами.
Діапазон від 0 до 15:
Діапазон між 15 і 30:
Отже, варіант d правильний, оскільки речовина А розкладається між 15 і 30 с зі швидкістю 0,03 моль. С.-1.
питання 8
Розглянемо наступну гіпотетичну реакцію.
aA + bB → cC + dD
Зверніть увагу на коливання концентрацій А та С нижче.
| Час | 0 | 5 | 10 | 15 | 20 | 25 |
|---|---|---|---|---|---|---|
| Витрата А (моль / л) | 7,5 | 6,0 | 4,5 | 3,0 | 2,5 | 1,0 |
| Освіта С (моль / л) | 0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 |
Виходячи з інформації, наведеної у запитанні, яка, відповідно, швидкість споживання А і швидкість утворення С в інтервалі між 5 і 25 хв?
а) 0,3 моль. L-1.s-1 і 0,1 моль. L-1.s-1
б) - 0,1 моль. L-1.s-1 і 0,3 моль. L-1.s-1
в) - 0,25 моль. L-1.s-1 і 0,1 моль. L-1.s-1
г) 0,1 моль. L-1.s-1 і 0,3 моль. L-1.s-1
Правильна альтернатива: в) - 0,25 моль. L-1.s-1 і 0,1 моль. L-1.s-1.
Норма споживання:
Швидкість навчання C:
Отже, в реакції A витрачається зі швидкістю 0,25 моль.с-1, тому його значення від’ємне, тоді як B утворюється зі швидкістю 0,1 моль. L-1.s-1.
Читайте теж:
- Хімічна кінетика
- термохімія
- Хімічний баланс
- Хімічні реакції