Alkanlarda sülfonasyon reaksiyonları onlar organik yer değiştirme reaksiyonları, üretmek amacı ile yürütülen sülfonik asitler (SO grubuna sahip organik bileşikler3Bir karbon atomuna veya bir karbon zincirine bağlı H) ve su (H2Ö).
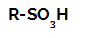
Bir sülfonik asidin yapısal formülü
üzerinde bir sülfonasyon reaksiyonu gerçekleştirmek için alkanlar, bir alkan (sadece karbon ve hidrojen atomlarıyla doymuş bir karbon zincirinden oluşan bileşik) ve sülfürik asit (H2SADECE4) konsantre, ısıtmaya tabi tutulur (∆).
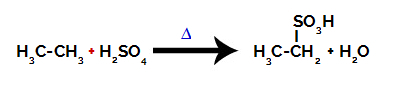
İki karbonlu bir alkanın sülfonasyonunu temsil eden kimyasal denklem
Alkanlarda sülfonasyon reaksiyonunun prensipleri
Gibi alkan sülfonasyon reaksiyonu bu bir ikame reaksiyonudur, içinde daha küçük bileşenler arasında bir değiş tokuş var elektronegatiflik reaktanların, yani alkan ve sülfürik asit arasında. Alkan hidrojen ve sülfonik grup olan sülfürik asit içerir.
Aşağıda, bir mekanizmanın adım adım adımını görüyoruz. alkanlarda sülfonasyon reaksiyonu. Örnek olarak, en basit alkan olan metan (CH4):
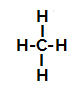
Metanın yapısal formülü
1. Adım: Sülfürik asitte hidroksil (OH) ve kükürt (S) arasındaki bağın bozulması.
Sülfürik asitte bulunan her hidroksil grubu, daha elektronegatif olmaları ile karakterize edilir. Reaksiyon sırasında ısıtma ile, hidroksil grubu ile kükürt arasındaki bağın kopması eğilimi vardır:
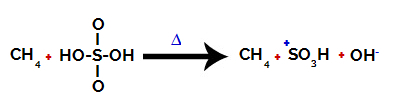
Kükürt ve hidroksil arasındaki bağın bozulması
Bununla birlikte, yapıdaki elektronik yeniden düzenleme nedeniyle tüm hidroksillerin bağının kopması meydana gelmez. Daha sonra bir hidroksit anyonu (OH) elde edilir.-) ve bir sülfonik katyon.
2. Adım: Alkan molekülüne hidroksil grubu saldırısı.
Daha sonra hidroksi grubu (OH-) alkana bir saldırı gerçekleştirerek karbon ve hidrojen arasındaki (aralarındaki elektronegatiflik farkı nedeniyle daha kırılgan olan) bağın kırılmasına neden olur.
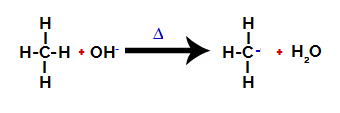
Alkanda karbon ve hidrojen arasındaki bağı kırmak
Not: Karbon ve hidrojen arasındaki bağın bozulması her zaman en sık olarak düşük elektronik yoğunluğu veya yükü olan karbonda meydana gelir. Karbon ne kadar az hidrojene sahipse veya ona ne kadar fazla grup bağlıysa elektron yoğunluğu o kadar düşük olur. Böylece sahibiz:
Üçüncül karbon < İkincil karbon < Birincil karbon
Bağ kırıldıktan sonra alkan, elektron eksikliği olan bir karbon (karbokasyon) haline gelir. Hidroksit grubu (OH)-) açığa çıkan hidrojen ile etkileşir ve bir su molekülü oluşturur.
3. Adım: Oluşan radikalin sülfonik gruba saldırısı.
Son olarak, sülfonik grup, alkanın geri kalanı tarafından saldırıya uğrar ve bir sülfonik asit oluşturur.
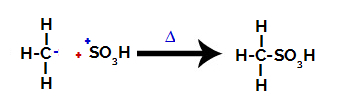
Etkileşen ve sülfonik asit oluşturan yapılar
Alkanlarda sülfonasyon reaksiyonlarını temsil eden denklem örnekleri
1. Örnek: Propanın sülfonasyonu.
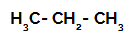
Propanın yapısal formülü
Propan, farklı miktarlarda hidrojene bağlı oldukları için farklı yüklere sahip iki birincil karbona ve bir ikincil karbona sahiptir. Karbon, hidrojenden daha elektronegatif olduğundan, bu karbonların elektron yoğunlukları farklıdır.
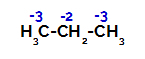
Propanın her bir karbon atomu üzerindeki yüklerin dağılımı
Birincil karbonlarda yük -3'tür (çünkü üç hidrojene bağlıdır) ve ikincil karbonda yük -2'dir (çünkü iki hidrojene bağlıdır). Böylece karbon ile hidrojen arasındaki bağda, bazen (bir molekülün) karbon 1'inde, bazen karbon 2'de (başka bir molekülün) bir kopukluk olacaktır.
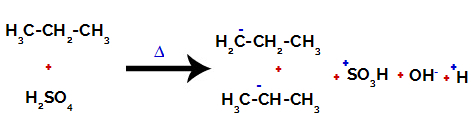
Farklı karbonlarda karbon ve hidrojen arasındaki bağı kırmak
Hem sülfürik asitte hem de alkanda bağlar arasındaki kopmalardan sonra, karbon 1 üzerindeki hidrojenin bir sülfonik grup tarafından yer değiştirmesi ile ürünler ve aynısı karbon üzerinde meydana gelir 2.
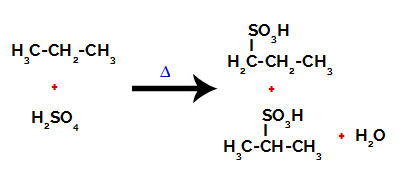
Propanın sülfonasyonundan oluşan ürünler
2. Örnek: 2-metil-bütanın sülfonasyonu.

2-metil-bütanın yapısal formülü
2-Metil-bütan, bir ikincil karbon ve bir üçüncül karbon olmak üzere üç birincil karbona sahiptir. aşağıdaki yapıda görülebileceği gibi farklı ücretler ve sonuç olarak farklı elektronik yoğunluklar:
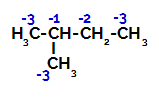
2-metil-bütanda elektronik yüklerin dağılımı
Bu nedenle, 2-metil-bütanda karbon ve hidrojen arasındaki bağı kırmanın birkaç olasılığı vardır, karbon 1 (bir molekülün), karbon 2 (başka bir molekülün), karbon 3 veya karbon üzerinde meydana gelebilir 4. Ancak 2 numaralı karbondaki bozulmanın daha yaygın olması dikkat çekicidir.
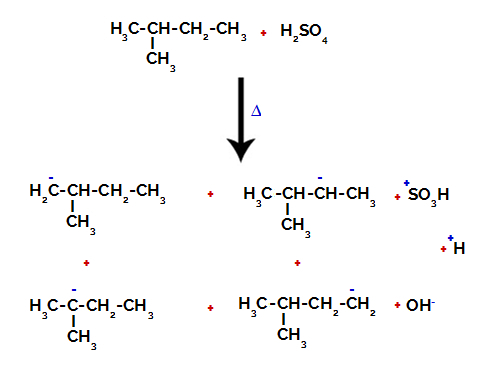
Farklı karbonlarda karbon ve hidrojen arasındaki bağı kırmak
Hem sülfürik asitte hem de alkanda bağlar arasındaki kırılmadan sonra, karbon 1 üzerindeki hidrojenin bir sülfonik grup tarafından yer değiştirmesi ile ürünler ve aynısı karbon 2.

2-metil-bütanın sülfonasyonundan oluşan ürünler
Benden Diogo Lopes Dias
Kaynak: Brezilya Okulu - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm
