Redoks reaksiyonlarının ana ayırt edici özelliği, aynı anda bir kimyasal türün elektron kaybetmesi (oksitleyerek) ve diğerinin elektron kazanmasıdır (indirgeyerek).
Ancak bazı reaksiyonlarda sadece oksidasyon ve/veya indirgeme olmadığını gözlemlemek mümkündür. Aşağıda bir örnek verilmiştir:
SnS + HCl + HNO3 → SnCl4 + S + HAYIR + H2Ö
Bu reaksiyondaki tüm atomların oksidasyon numaralarını (Nox) “Oksidasyon Numarasının (Nox) Belirlenmesi” metninde öğretildiği gibi hesaplayarak, şunları elde ederiz:
+2 -2 +1 -1 +1 +5 -2 +4 -1 0 +2 -2 +1 -2
SnS + HCl + HNO3 → SnCl4 + S + HAYIR + H2Ö
Şimdi kontrol edelim hangilerimaddeler Nox'larında değişikliklere uğradı ve sonuç olarak oksitlenen ve indirgenen:
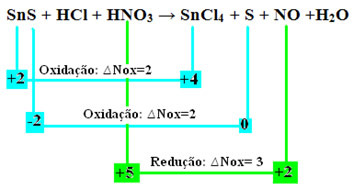
İki oksidasyonun meydana geldiğine dikkat edin. Peki bu durumda kimyasal denklem nasıl dengelenir?
Tüm redoks reaksiyonları için geçerli olan akılda tutulması gereken önemli bir şey şudur: verilen elektronların sayısı her zaman alınan elektronların sayısına eşit olmalıdır.
Bu nedenle, bu tür bir tepkiyi dengelemek için metinde belirtilen aynı kuralları izleyin "
Redoks dengeleme”, ancak tek bir değişiklikle: iki oksidasyonu (SnS) oluşturan türlerin Nox varyasyonunun (∆Nox) belirlenmesi, bize kayıp elektronların toplam değerini verecek olan iki ∆Nox'un toplamı olacaktır:- SnS: ∆Toplam Nox = (∆Nox SnCl4) + (∆Nox S)
SnS: ∆Toplam NOx = 2 + 2 = 4
- HNO3: ∆Nox = 3
Böylece, dengeleme için aşağıdaki adımlarla devam edebiliriz:
Şimdi durma... Reklamdan sonra devamı var ;)
- SnS: ∆Toplam NOx = 4 → 4 HNO katsayısı olacak3;
- HNO3: ∆Nox = 3 → 3 SnS'nin katsayısı olacaktır.
3 SnS + HCl + 4 HNO3 → SnCl4 + S + HAYIR + H2Ö
Deneme yöntemi ile dengelemeye devam edilmesi:
- 1. üyede 3 Sn ve 3 S olduğu için bunlar da 2. üyede katsayılarınız olacaktır:
3 SnS + HCl + 4 HNO3 → 3 SnCl4 + 3 Y+HAYIR+H2Ö
- Bununla 2. üyeye 12 Cl (3. 4 = 12), yani 12, Cl'nin 1. üyede bulunduğu HCl olan maddenin katsayısı olacaktır:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + HAYIR +H2Ö
- Şimdi 1. üyede (12 + 4 = 16) 16 H var, dolayısıyla H katsayısı2O, 8'e eşit olacaktır, çünkü 8, 2 olan hidrojen indeksi ile çarpıldığında 16 verir:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + HAYIR +8H2Ö
- Ayrıca, 1. üyede de 4 N vardır, dolayısıyla 4, 2. üyede N'nin katsayısı olacaktır:
3 SnS + 12 HCl + 4 HNO3 → 3 SnCl4 + 3 S + 4 HAYIR +8 H2Ö
1. uzuvdaki oksijen miktarının (3. 4 = 12) o elementin 2. uzuvdaki toplam miktarına (4 + 8 = 12) eşittir. Yani reaksiyon dengelidir.
Jennifer Foğaça tarafından
Kimya mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bakmak:
FOGAÇA, Jennifer Rocha Vargas. "Birden fazla oksidasyon ve/veya indirgeme ile reaksiyonlar"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/reacoes-com-mais-uma-oxidacao-ou-reducao.htm. 27 Temmuz 2021'de erişildi.


