Günlük yaşamda ve laboratuvarlarda, kendiliğinden olan ve kendiliğinden olmayan reaksiyonlar ve dönüşümler vardır. Örneğin, tüm yanma kendiliğinden bir reaksiyondur, çünkü bir kez başladıktan sonra tüm yakıt tükenene veya tüm oksijen bitene kadar devam edecektir.
Öte yandan, elektroliz, elektrik enerjisinin kimyasal enerjiye dönüştürüldüğü kendiliğinden olmayan bir süreçtir. Bir örnek, sodyum klorürün (NaCl) elektrolizidir. Bu erimiş tuzun üzerinden bir elektrik akımı geçirildiğinde redoks reaksiyonları ve metalik sodyum (Na) oluşumu gerçekleşir.(ler)) ve klor gazı (Cl2(g)). Elektrik akımını durdurursak, reaksiyon kendi kendine devam etmeyecek, bu da kendiliğinden olmadığını gösteriyor.
Bir reaksiyonun kendiliğindenliği aşağıdaki formül kullanılarak ölçülebilir: Gibbs-Helmholtz denklemi, aşağıda verilen:

Ne üzerine:
∆G = serbest enerjinin değişimi;
∆H = entalpi değişimi;
T = Kelvin cinsinden sıcaklık (her zaman pozitif);
∆S = entropi değişimi.
Bu denklem adını Amerikalı fizikçi J. Willard Gibbs (1839-1903) ve Alman fizikçi Hermann Helmholtz (1821-1894).
Bu denklemin bir reaksiyonun kendiliğindenliğini belirlememize nasıl yardımcı olduğunu daha iyi anlamak için, içinde yer alan kavramların her birini kısaca gözden geçirelim:
- ∆H (entalpi değişimi): Entalpi (H), bir maddenin enerji içeriğidir. Şimdiye kadar, bunu belirlemenin bir yolu bilinmiyor. Pratikte elde edilen şey, kalorimetreler kullanarak bir işlemin entalpi değişimini (∆H) ölçmektir. Bu varyasyon miktarı süreçte açığa çıkan veya emilen enerji.
- ∆S (entropi değişimi):Entropi (S), bir sistemdeki düzensizliğin derecesini ölçen termodinamik niceliktir.
Örneğin, eriyen buzda moleküller katı halden daha fazla düzensizliğin olduğu sıvı hale geçerler. Bu, bu süreçte entropinin arttığı anlamına gelir (∆S > 0).
Şimdi durma... Reklamdan sonra devamı var ;)
Amonyak üretiminde (NH3), 1 mol nitrojen gazı 3 mol hidrojen gazı (yani reaktanlardaki 4 mol molekül) ile reaksiyona girerek 2 mol amonyak oluşturur:
N2(g) +3 Saat2(g) → 2 NH3(g)
Bu süreçte gaz fazındaki molekül sayısı azaldığından düzensizlik azalmış, yani entropi de azalmıştır (∆S< 0).
- ∆G (Serbest enerji): Serbest enerji veya Gibbs serbest enerjisi (çünkü sadece bu bilim adamı tarafından 1878'de önerilmiştir) iş yapmak için kullanılan sistemin faydalı enerjisi.
Bir sistem küresel enerjiye sahiptir, ancak bu enerjinin yalnızca bir kısmı iş yapmak için kullanılacaktır, buna Gibbs serbest enerjisi denir ve ile sembolize edilir. G.
Gibbs'e göre, bir süreç iş yapıyorsa, yani G azalırsa kendiliğinden kabul edilir.. Bu durumda, ofG < 0 olduğunda dönüşümün son hali ilk halinden daha kararlı olacaktır.
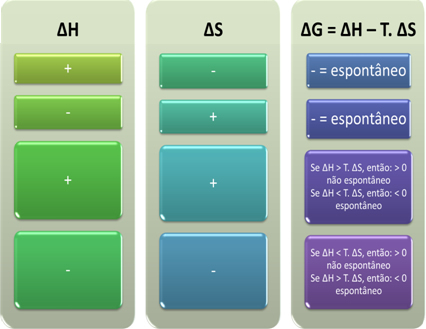
Buna dayanarak, aşağıdakileri sonuçlandırabiliriz:

Gibbs-Helmholtz denklemindeki ∆H ve ∆S'nin cebirsel işaretine bakarak bir sürecin kendiliğinden olup olmayacağını da görebiliriz:
Jennifer Foğaça tarafından
Kimya mezunu
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
FOGAÇA, Jennifer Rocha Vargas. "Gibbs Serbest Enerjisi"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm. 28 Haziran 2021'de erişildi.


