Kolligatif özellikler ile ilgili çalışmaları içerir. çözeltilerin fiziksel özellikleri, daha doğrusu bir çözücünün bir çözünen varlığında.
Bildiğimiz kadarıyla olmasa da, kolligatif özellikler endüstriyel işlemlerde ve hatta çeşitli günlük durumlarda yaygın olarak kullanılmaktadır.
Bu özelliklerle ilgili fiziksel sabitlerörneğin, belirli maddelerin kaynama veya erime sıcaklığı.
Örnek olarak, araba radyatörlerine katkı maddeleri eklemek gibi otomobil endüstrisi sürecini verebiliriz. Bu, daha soğuk yerlerde radyatördeki suyun neden donmadığını açıklar.
Etin tuzlanması ve hatta şekerle doyurulması gibi gıdalarla yapılan işlemler, organizmaların bozulmasını ve çoğalmasını engeller.
Ayrıca suyun tuzdan arındırılması (tuz giderme) ve yer yer kar üzerine tuzun yayılması Kışın çok sert geçtiği yerlerde kolligatif etkileri bilmenin önemini doğrulamaktadır. çözümler.
Koligatif özelliklerle ilgili kavramlar hakkında daha fazla bilgi edinmek ister misiniz? Makaleleri okuyun:
- Suyun Fiziksel Halleri
- Erime Noktası ve Kaynama Noktası
- Suyun tuzdan arındırılması
- Karışımların Ayrılması
Çözücü ve Çözünen
Öncelikle şu kavramlara dikkat etmeliyiz. çözücü ve çözünen, bir çözümün her iki bileşeni:
- çözücü: Çözünen madde.
- çözünen: çözünmüş madde.
Örnek olarak, suyun çözücüyü ve tuzun çözünen maddeyi temsil ettiği tuzlu bir su çözeltisini düşünebiliriz.
Daha fazlasını öğrenmek ister misiniz? sen de oku çözünürlük.
Kolligatif Etkiler: Kolligatif Özellik Türleri
Kolligatif etkiler, bir çözeltinin çözünenleri ve çözücüleri ile meydana gelen olaylarla ilişkilidir ve şu şekilde sınıflandırılır:
Tonometrik Etki
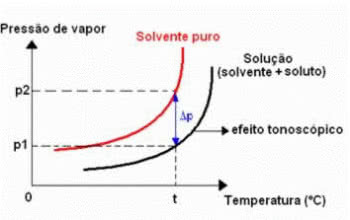
Tonometri olarak da adlandırılan tonoskopi, gözlenen bir olgudur. bir sıvının maksimum buhar basıncında azalma (çözücü).
Tonometrik Etki Tablosu
Bu, uçucu olmayan bir çözünen maddenin çözünmesi yoluyla gerçekleşir. Bu nedenle, çözünen çözücünün buharlaşma kapasitesini azaltır.
Bu tür koligatif etki aşağıdaki ifade ile hesaplanabilir:
ΔP =p0 -P
Nerede,
ΔP: çözeltiye maksimum buhar basıncının mutlak düşürülmesi
P0: t sıcaklığında saf sıvının maksimum buhar basıncı
P: t sıcaklığında çözeltinin maksimum buhar basıncı
Ebüliometrik Etki
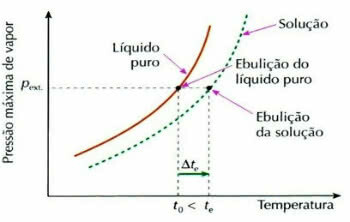
Ebulliyometri olarak da adlandırılan ebullioskopi, bir sıvının sıcaklık değişimindeki artış kaynatma işlemi sırasında.
Ebüliometrik Etki Grafiği
Bu, uçucu olmayan bir çözünenin çözünmesiyle gerçekleşir, örneğin kaynamak üzere olan suya şeker eklediğimizde sıvının kaynama sıcaklığı yükselir.
Sözde ebulliometrik (veya ebuliskopik) etki aşağıdaki ifade ile hesaplanır:
tve = tve - t0
Nerede,
tve: çözeltinin kaynama sıcaklığındaki artış
tve: çözeltinin ilk kaynama sıcaklığı
t0: saf sıvının kaynama sıcaklığı
Kriyometrik Etki
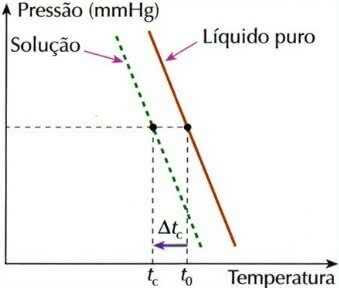
Kriyometri olarak da adlandırılan kriyoskopi, donma sıcaklığı düşüşübir çözüm.
Kriyometrik Etki Grafiği
Bunun nedeni, uçucu olmayan bir çözünen bir sıvı içinde çözündüğünde, sıvının donma sıcaklığının düşmesidir.
Kriyoskopi örneği, sıcaklığın çok düşük olduğu yerlerde araba radyatörlerine yerleştirilen antifriz katkılarıdır. Bu işlem suyun donmasını önleyerek araba motorlarının ömrüne yardımcı olur.
Ayrıca kışın çok soğuk geçtiği yerlerde sokaklara yayılan tuz, yollarda buz birikmesini de engelliyor.
Bu koligatif etkiyi hesaplamak için aşağıdaki formül kullanılır:
tç = t0 - tç
Nerede,
tç: çözeltinin donma sıcaklığının düşürülmesi
t0: saf çözücünün donma sıcaklığı
tç: Çözeltideki çözücünün ilk donma sıcaklığı
Bu mülkle ilgili bir denemeye şu adresten bakın: Kimya Deneyleri
Raoult Yasası
Sözde “Raoult Yasası” Fransız kimyager François-Marie Raoult (1830-1901) tarafından önerildi.
Kimyasal maddelerin moleküler kütlelerinin çalışmalarına yardımcı olarak koligatif etkileri (tonometrik, ebuliometrik ve kriyometrik) inceledi.
Suyun erimesi ve kaynamasıyla ilgili olayları inceleyerek şu sonuca vardı: 1 mol 1 kg çözücüde herhangi bir uçucu olmayan ve iyonik olmayan çözünen, her zaman aynı tonometrik, ebuliometrik veya kriyometrik.
Böylece, Raoult Yasası aşağıdaki gibi ifade edilebilir:
“Uçucu olmayan ve iyonik olmayan çözünen bir çözeltide, koligatif etki, çözeltinin molalitesi ile orantılıdır.”.
Aşağıdaki gibi ifade edilebilir:
Pçözüm = xçözücü. Psaf çözücü
Ayrıca hakkında okuyun Mol Sayısı ve Molar Kütle.
ozmometri
Osmometri, aşağıdakilerle ilgili bir koligatif özellik türüdür. çözeltilerin ozmotik basıncı.
Ozmozun, suyun daha az konsantre (hipotonik) bir ortamdan daha konsantre (hipertonik) bir ortama geçişini içeren fizikokimyasal bir süreç olduğunu unutmayın.
Bu, yalnızca suyun geçişine izin veren yarı geçirgen bir zar aracılığıyla gerçekleşir.
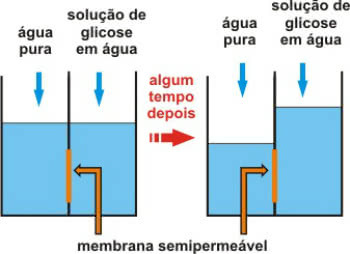
Bir süre sonra yarı geçirgen membran etkisi
Arama ozmotik basınç suyun hareket etmesini sağlayan basınçtır. Başka bir deyişle, saf çözücüyü yarı geçirgen zardan geçirerek seyrelmesini engelleyen çözeltiye uygulanan basınçtır.
Bu nedenle ozmometri, çözeltilerdeki ozmotik basıncın incelenmesi ve ölçülmesidir.
Suyu tuzdan arındırma tekniğinde (tuz giderme) adı verilen işlemin ters osmoz.
hakkında daha fazla bilgi edinin ozmoz.
Osmometri Kanunları
Hollandalı fizikçi ve kimyager Jacobus Henricus Van't Hoff (1852-1911), ozmometri ile ilgili iki yasayı varsaymaktan sorumluydu.
Birinci yasa şu şekilde ifade edilebilir:
“Sabit sıcaklıkta ozmotik basınç, çözeltinin molaritesiyle doğru orantılıdır.”
Önerdiği ikinci yasada, aşağıdaki ifadeye sahibiz:
“Sabit molaritede, ozmotik basınç, çözeltinin mutlak sıcaklığı ile doğru orantılıdır.”
Bu nedenle, moleküler ve seyreltilmiş çözeltilerin ozmotik basıncını hesaplamak için aşağıdaki formül kullanılır:
π = MRT
olmak,
π: çözelti ozmotik basıncı (atm)
M: çözelti molaritesi (mol/L)
$: mükemmel gazların evrensel sabiti = 0.082 atm. L/mol. K
T: çözeltinin mutlak sıcaklığı (K)
sen de oku molarite.
Geri Bildirimli Giriş Sınavı Alıştırmaları
1. Aynı ocakta aynı anda iki aynı brülörde bulunan iki tava karşılaştırıldığında, basıncın Kapalı bir düdüklü tencerede kaynayan sudaki gazların miktarı düdüklü tencerede kaynayan sudakinden daha fazladır açık.
Bu durumda ve eğer tüm bileşenlerden tam olarak aynı miktarda içeriyorlarsa, açık tavada olanlara kıyasla düdüklü tencerede pişirme süresinin kapalı olacaktır:
a) kaynama sıcaklığı daha düşük olacağından daha düşük.
b) kaynama sıcaklığı daha yüksek olacağından daha düşük.
c) kaynama sıcaklığı basınçla değişmediğinden daha küçüktür.
d) eşittir, çünkü kaynama sıcaklığı basınçtan bağımsızdır.
e) basınç daha yüksek olacağından daha yüksek.
alternatif b
2. (UFRN) Şiddetli kış aylarında, araba radyatörlerindeki suya belirli bir miktar etilen glikol ilave edilmesi adettendir. Soğutucu olarak su yerine bir çözelti kullanılmasının nedeni, çözeltinin aşağıdaki özelliklere sahip olmasıdır:
a) düşük füzyon ısısı.
b) daha düşük donma noktası.
c) daha yüksek donma noktası.
d) daha yüksek füzyon ısısı.
alternatif b
3. (Vunesp) Yaraları iyileştirmenin yollarından biri de yaygın inanışa göre üzerlerine şeker veya kahve tozu sürmektir. Açıklanan prosedürle sıvının uzaklaştırılmasını en iyi açıklayan koligatif özellik, iyileşmeyi destekleyen şu şekilde incelenir:
a) ozmometri.
b) kriyoskopi.
c) endoskopi.
d) tonoskopi.
e) ebulliometri.
alternatif
4. (UFMG) Bir dondurucuda, farklı sıvılar içeren buz ve limonlu dondurma yapmanın beş yolu vardır. Kalıplar aynı anda dondurucuya yerleştirilirse ve başlangıçta aynı sıcaklıktaysa, önce 500 ml: içeren kalıp dondurulur.
a) saf su.
b) 50 ml limon suyu içeren su içinde çözelti.
c) suda 100 ml limon suyu içeren çözelti.
d) 50 ml limon suyu ve 50 g şeker içeren su içinde çözelti.
e) 100 ml limon suyu ve 50 g şeker içeren su içindeki çözelti.
alternatif
5. (Cesgranrio-RJ) Bir x maddesinin erime noktası belirlendi ve bu madde için çizelgeden daha düşük bir değer bulundu. Bu şu anlama gelebilir:
a) Tespitte kullanılan madde miktarının gereğinden az olması.
b) Tespitte kullanılan madde miktarının gereğinden fazla olması.
c) maddenin bir kısmı erimemiştir.
d) madde safsızlıklar içerir.
e) madde %100 saftır.
Alternatif