bu damıtma kaynama yoluyla gerçekleşen homojen karışımların, sıvının buharlaştırılıp yoğunlaştırıldığı ayırma işlemlerinden biridir. Böylece ayrılacak karışımların kaynama noktaları farklıdır.
Başka bir deyişle, damıtma, karışımların ısıtılması ve soğutulması yoluyla gerçekleşen karışımların fizikokimyasal olarak ayrılması işlemidir. Karışım ısıtıldığında önce kaynama noktası en düşük yani en uçucu olan madde buharlaştırılır.
Damıtma, kimya laboratuvarlarında ve endüstrilerde özel ekipman (kondenser, termometre, damıtma, bunsen nozulu, beher, ısıtma mantosu, fraksiyonasyon kolonu), örneğin suyu alkolden veya suyu alkolden ayırırken tuz.
Damıtma işleminin doğal bir örneği, su damlacıklarının daha soğuk günlerde yoğunlaşmasıyla görülür. Ayrıca distile olarak adlandırılan içecekler (cachaça, votka, brendi, tekila, rom, viski) eski çağlardan beri kullanılan fraksiyonel damıtma işlemi ile üretilmektedir.
Damıtma Türleri
Damıtma, ayrı karışımların doğasına bağlı olarak iki şekilde gerçekleşebilir:
Basit Damıtma
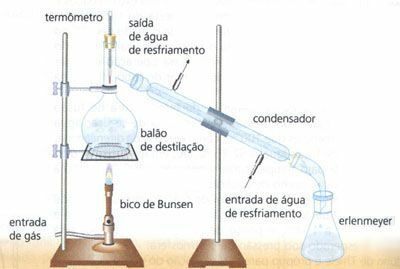 Basit Damıtma
Basit Damıtma
Homojen bir katı ve sıvı karışımının ayrılması, örneğin su (H2O) tuzunun (NaCl). Bu şekilde kondenserden geçen su ısıtma yoluyla buharlaştırılır. Tuzun tutulduğu ve adı verilen bir kapta ayrıldığı sıvı (su damlacıkları). damıtma.
Kademeli damıtma
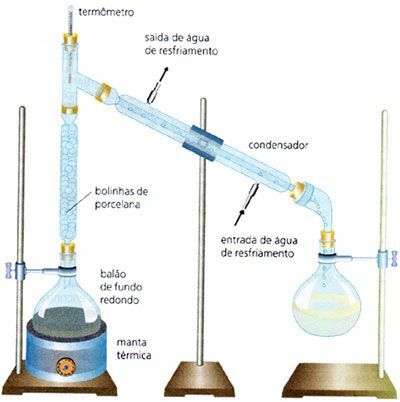 Kademeli damıtma
Kademeli damıtma
Endüstride yaygın olarak kullanılan, homojen bir sıvı ve sıvı karışımının, örneğin, su ve alkol (Suyun kaynama noktası 100°C ve etil alkolün kaynama noktası 78°C'dir). Kaynama noktaları çok yakın olan karışımlarla yapılır. Basit damıtma işleminden farklı olarak, bu durumda bir fraksiyonasyon kolonu vardır.
Yağ Damıtma
Petrol ürünleri (benzin, gazyağı, akaryakıt, parafin, asfalt) elde etmek için, damıtma işlemi fraksiyonlu, en düşük kaynama noktasına sahip sıvının, en yüksek kaynama noktasına sahip sıvıya ulaşana kadar ilk olarak ayrıldığı yerde kullanılır. kaynamak.
unutmayın ki Petrol başta hidrokarbonlar (karbon ve hidrojen molekülleri) olmak üzere birçok organik bileşenden oluşan doğal bir maddedir.
azeotropik damıtma
Azeotropik damıtma, karışımların ayrılması bir azeotrop oluşturduğunda, yani düşük uçuculuğa ve noktaya sahip olduklarında meydana gelir. basit damıtma yöntemiyle ayrılamayan sabit kaynama noktaları, örneğin hidroklorik asit (HCL) ve su (H2Ö).
Eğlenceli Gerçekler: Biliyor muydunuz?
Distile Su (demineralize su) damıtılarak elde edilen saf bir maddedir ve genellikle laboratuvarda kullanılır. Unutmayın içtiğimiz su saf değildir, yani mineral tuzlar içerir. Bununla birlikte, damıtılmış su, insan tüketiminin yanı sıra böbrek taşı gibi bazı hastalıkların tedavisinde de kullanılabilir.
Makaleleri okuyarak araştırmanızı tamamlayın:
- Erime ve kaynama noktası
- Sıvılaşma veya Yoğunlaşma
- buharlaşma
- Karışımların Ayrılması
Yorum yapılan geri bildirimlerle giriş sınavı sorularını kontrol edin: karıştırma ayırma alıştırmaları.