Bir aynı çözünenin çözeltilerinin kimyasal tepkime olmadan karıştırılması örneğin potasyum klorür (Kcl) ile aynı kapta iki çözeltinin bir araya getirilmesinden oluşur. Bu tür bir karışımda, eşit çözünenlerin varlığından dolayı hiçbir zaman kimyasal reaksiyon olmayacaktır, yani her ikisi de aynı katyona ve aynı anyona sahiptir. Böylece, bu özelliklere sahip bir karışım yaptığımızda, sadece her iki çözeltiyi oluşturan çözünen ve çözücü miktarlarını eklediğimizi söyleyebiliriz.
Örneğin, 1 L su ve 4 gram KI (potasyum iyodür) çözeltisini başka bir 2L su ve 6 gram KI çözeltisi ile karıştırırsak, yeni bir 3L su ve 10 gram KI çözeltisi elde ederiz. .
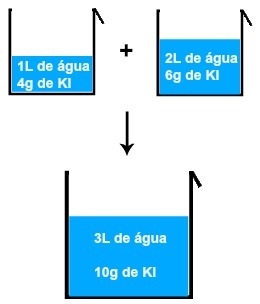
İki potasyum iyodür çözeltisinin karıştırılmasının sonucu
Görüntüyü analiz ederek, şu sonuca varabiliriz: çözünenin kütlesi (m1') birinci çözeltinin kütlesine (m1'') ikinci çözümün, çözünenin kütlesi ile sonuçlanan (mF) nihai çözümde (Karıştırma):
m1' + m1'' = mF
Örnekte:
4 + 6 = 10 gram
Aynısı, her çözeltide bulunan su hacmi ile olur, yani, ikincinin (V'') hacmine eklenen birincinin (V') hacmi, son hacim (V') ile sonuçlanır.F):
V' + V'' = VF
Örnekte:
1 + 2 = 3 L
Her çözeltinin bir miktar çözünmüş çözüneni olduğu ve burada aynı çözünenin çözeltilerinin bir karışımına sahip olduğumuz için, daha sonra, yukarıdan, karışık çözeltilerin her birinin ve ayrıca nihai çözeltinin konsantrasyonunu (ortak, molarite) belirleyebiliriz..
Bu nedenle, bu konsantrasyonları hesaplamak için formülleri hatırlamalıyız:
Ortak konsantrasyon:
C = m1
V
m1 = çözelti çözünen kütlesi
V = çözelti hacmi
NOT: m'yi izole etmek1 formülde, biz var: m1 = özgeçmiş
molarite:
M = m1
M1.V
M1 = çözünenin molar kütlesi.
NOT: m'yi izole etmek1 formülde, biz var: m1 = AA1.V
Aynı çözünenin çözeltilerinin karışımı, çözeltilerin çözünenin kütlesinin toplamını ele aldığından, gözlemlerin her birini aşağıdaki ifadede değiştirebiliriz:
m1' + m1'' = mF
C'.V' + C''.V'' = CF.VF
Şimdi durma... Reklamdan sonra devamı var ;)
C' = çözelti 1'in ortak konsantrasyonu
C'' = çözelti 2'nin ortak konsantrasyonu
Çözelti karışımının hesaplanması molarite içeriyorsa:
m1' + m1'' = mF
M'.V' + M''.V'' = MF.VF
NOT: Çözünen madde aynı olduğundan, çözeltilerin her birinde molar kütle aynıdır; bu nedenle, hesaplamada ihmal edilir.
şimdi gör kimyasal reaksiyon olmadan aynı çözünen çözeltilerin bir karışımındaki hesaplamaları kapsayan örnekler:
Örnek 1: (Mackenzie-SP-Adaptada) Aynı bazın belirli bir hacmi (v) 84 g/L çözeltisine 600 mL 14g/L KOH çözeltisi eklenerek 67.2g/L'lik bir çözelti elde edilir. 84 g/L solüsyonun eklenen hacmi (v):
a) 0100 mL
b) 3000 ml
c) 2700 ml
d) 1500 ml
e) 1900 mL
Tatbikatın sağladığı veriler şunlardı:
V' = 600 mL
C' = 14 g/L
V'' = ?
C'' = 84 g/L
VF = ?
CF = 67,2 g/L
Çözüm 1'in eklenen hacmini belirlemeden önce, ilk olarak aşağıdaki ifadeyi kullanarak son hacmi belirlememiz gerekir:
V' + V'' = VF
600 + V'' = VF
Aşağıdaki matematiksel ifadede verilen değerleri yerine koyarsak:
C'.V' + C''.V'' = CF.VF
14. 600 + 84.V'' = 67.2.(600 + V'')
8400 + 84.V'' = 67.2. 600 + 67.2.V''
8400 + 84.V'' = 40320 + 67.2.V''
84.V'' – 67.2.V'' = 40320 – 8400
16.8.V'' = 31920
V'' = 31920
16,8
V'' = 1900 mL
Örnek 2: (UFOP) 1000mL ölçülü balona 250mL 2M sülfürik asit çözeltisi 300mL aynı asitin 1M çözeltisi ilave edildi ve hacim distile su ile 1000mL'ye tamamlandı. Elde edilen çözeltinin molaritesini belirleyin.
Tatbikatın sağladığı veriler şunlardı:
V' = 250 mL
M' = 2 M
V'' = 300 mL
M'' = 1 M
VF = 1000ml
MF = ?
Nihai çözümün molaritesini belirlemek için, süreci temsil eden matematiksel ifadeyi kullanmanız yeterlidir:
M'.V' + M''.V'' = MF.VF
2. 250 + 1. 300 = MF.1000
500 + 300 = MF. 1000
800 = MF
1000
MF = 0.8 mol/L
Benden Diogo Lopes Dias
Bu metne bir okulda veya akademik bir çalışmada atıfta bulunmak ister misiniz? Bak:
GÜNLER, Diogo Lopes. "Aynı çözünenin kimyasal reaksiyon olmadan çözeltilerinin karışımı"; Brezilya Okulu. Uygun: https://brasilescola.uol.com.br/quimica/mistura-solucoes-mesmo-soluto-sem-reacao-quimica.htm. 27 Haziran 2021'de erişildi.